
����Ŀ�������ƻ���к��е��ۡ������Ǻ����εȣ�ij������ȤС�������һ��ʵ��֤��ijЩ�ɷֵĴ��ڣ�������벢Э������������ʵ�顣
��1����С�Թ�ȡ������ƻ��֭������_______(�����ƣ�����Һ��������֤��ƻ���к��е��ۡ�
��2�����ú����۵����ʿ����������ᡣ�������������������ͼ���Իش��������⣺
![]()
B���ճ���������������ζ�ij����л������Щ�����к���B��
��д����ѧ����ʽ����ע����Ӧ���͡�
B����ᷴӦ:____________________________������______________��Ӧ��
B��C____________________________������____________________________��Ӧ��
�ڿ����ڼ���A���Լ���____________________________��
���𰸡���ˮ CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O ȡ������������ 2CH3CH2OH+O2
CH3COOCH2CH3+H2O ȡ������������ 2CH3CH2OH+O2![]() 2CH3CHO+2H2O ���� ���Ƶ�������ͭ����Һ�������𰸾��ɣ�
2CH3CHO+2H2O ���� ���Ƶ�������ͭ����Һ�������𰸾��ɣ�
��������
(1)�ⵥ�������۱���ɫ��
(2)������������������ˮ�����������ǣ��������ڴ����������������Ҵ����Ҵ��ɱ�����Ϊ��ȩ���������������
���������к���ȩ����
(1)ƻ���к��е��ۣ��ⵥ�������۱���ɫ����ƻ��֭�м����ˮ����Һ��������ƻ���к��е��ۣ�
(2)����������������ˮ�����������ǣ��������ڴ����������������Ҵ����Ҵ��ɱ�����Ϊ��ȩ���������������ᣬ��AΪ�����ǣ�BΪ�Ҵ���CΪ��ȩ��
���Ҵ���������Ũ���������·�������(ȡ��)��Ӧ����������������Ӧ�ķ���ʽΪCH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O��BΪ�Ҵ���CΪ��ȩ���Ҵ����ڴ��������·���������������ȩ����Ӧ�ķ���ʽΪ2CH3CH2OH+O2
CH3COOCH2CH3+H2O��BΪ�Ҵ���CΪ��ȩ���Ҵ����ڴ��������·���������������ȩ����Ӧ�ķ���ʽΪ2CH3CH2OH+O2![]() 2CH3CHO+2H2O��
2CH3CHO+2H2O��
���������к���ȩ�������������ǿ������Ƶ�������ͭ����Һ�����Ⱥ�������ש��ɫ�����������ˮ�����������ǡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ж���ȷ����(NA��ʾ�����ӵ�����)�� ��
A.����c(OH��)/c(H+)=10-13����Һ�п��ܺ���K+��Fe2+��NO3����Cl����������
B.1 L 0.1molL-1��CH3COONa��Һ��CH3COO����OH������������0.1NA
C.���ӹ�ҵ����30%���Ȼ�����Һ��ʴ����ӡˢ��·���ϵ�ͭ����Fe3+ +Cu = Fe2++Cu2+
D.H2��ȼ����Ϊa kJ��mol��1��H2ȼ���ȵ��Ȼ�ѧ����ʽΪ��O2(g) +2H2(g) = 2H2O(l) ��H = ��2a kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʮ�Ŵ������Ҫ����Ӯ���챣��ս������ζ�Ŷ���Ⱦ���αȹ�ȥҪ����ߡ�ij������������Һʵ�ַ��硢������λһ���ϵ�װ��ʾ��ͼ���£�����װ�ù���ʱ������˵����ȷ����( )
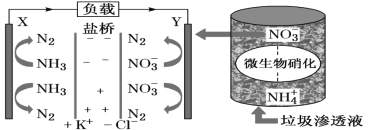
A.������Cl-��Y���ƶ�
B.Y�������ķ�ӦΪ2NO3����10e-��6H2O=N2����12OH-����ΧpH����
C.������X���ص�������Y��
D.��·������7.5mol����ʱ����������״����N2�����Ϊ16.8L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NaNO3��HCl�Ļ����Һ400mL��������Һ�����������Fe�ۣ���ͼ��ʾ��(��Ӧ��HNO3ֻ����ԭ��NO)����˵����ȷ����

A. �����Ƶ����ʵ���Ũ��Ϊ2.5mol/L
B. ����£���Ӧ���̹�����22.4L������
C. ������Ӧ������ÿ��ת�Ƶĵ���֮��Ϊ4mol
D. ����Ӧ��Ļ������ˣ���Һ�����ᾧ���ù���Ϊ NaCl��FeCl2�Ļ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(H3AsO3)�����������ư�Ѫ��,����Һ�д��ڶ�������̬����1L0.1mol��L-1H3AsO3��Һ����μ���KOH��Һ�����������ʵ�����������Һ��pH ��ϵ����ͼ��ʾ������˵����ȷ���ǣ� ��
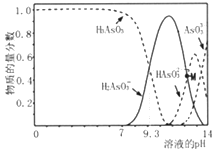
A. H3AsO3�ĵ��볣��Ka1��������Ϊ10-9
B. pH��8.0��10.0ʱ,��Ӧ�����ӷ���ʽ��H3AsO3+OH-=H2AsO3-+H2O
C. M���Ӧ����Һ�У�c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1mol��L-1
D. pH=12ʱ,��Һ�У�c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ֱ��ʾ�йط�Ӧ�ķ�Ӧ�����������仯�Ĺ�ϵ��
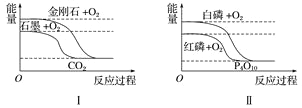
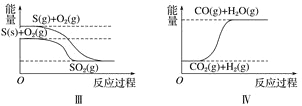
�ݴ��ж�����˵������ȷ����(����)
A. ʯīת��Ϊ���ʯ�����ȷ�Ӧ B. ���ױȺ����ȶ�
C. S(g)��O2(g)===SO2(g)����H1S(s)��O2(g)=SO2(g)����H2������H1>��H2 D. CO(g)��H2O(g)=CO2(g)��H2(g)����H>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ѣ�![]() ������Ϊ��������֮��ĵ����������Ѱף�
������Ϊ��������֮��ĵ����������Ѱף�![]() ����Ŀǰʹ����㷺�İ�ɫ���ϡ��Ʊ�
����Ŀǰʹ����㷺�İ�ɫ���ϡ��Ʊ�![]() ��
��![]() ��ԭ�����������ú�
��ԭ�����������ú�![]() ����������Ҫ�ɷ�Ϊ
����������Ҫ�ɷ�Ϊ![]() ���Ʊ�
���Ʊ�![]() ���������£�
���������£�
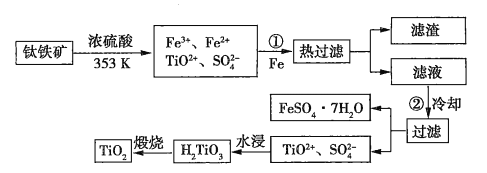
��1������ټ�![]() ��Ŀ����________________________���������ȴ��Ŀ����__________________��
��Ŀ����________________________���������ȴ��Ŀ����__________________��
��2�����dzɱ��ͷ�����ۺ����õ����أ�ˮ����ķ�Һ��Ӧ����_______������
��3���ɽ��ʯ��![]() ����ȡ�����ѣ�
����ȡ�����ѣ�![]() ���Ĺ���Ϊ
���Ĺ���Ϊ![]() �����з�Ӧ
�����з�Ӧ![]() ����������н��е�������______________________________��
�����������������______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(C1NO)���л��ϳ��е���Ҫ�Լ�������NO��Cl2��ͨ�������·�Ӧ�õ�����ѧ����ʽΪ2NO(g)+C12(g)![]() 2C1NO(g)��
2C1NO(g)��
��1�����������������ڴ����еĺ������������ʱ�������������ȣ��漰���·�Ӧ��
�� 2NO2(g)+NaC1(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
�� 4NO2(g)+2NaC1(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
�� 2NO(g)+C12(g)![]() 2C1NO(g) K3
2C1NO(g) K3
��K1��K2��K3֮��Ĺ�ϵΪK3=______________��
��2����֪���ֻ�ѧ���ļ����������±�(�������ȵĽṹΪCl-N=O):

��2NO(g)+C12(g)![]() 2C1NO(g)��Ӧ����H��a�Ĺ�ϵΪ��H=________kJ/mol��
2C1NO(g)��Ӧ����H��a�Ĺ�ϵΪ��H=________kJ/mol��
��3����1L�ĺ����ܱ������г���2molNO(g)��1molC12(g)���ڲ�ͬ�¶��²��c(C1NO)��ʱ��Ĺ�ϵ��ͼA:
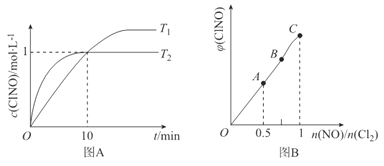
�� ��ͼA���ж�T1 ________T2���÷�Ӧ����H________0 (����>����<������=��)��
�� ��Ӧ��ʼ��10minʱNO��ƽ����Ӧ����v(NO)=____________mol/(L��min)��
�� T2ʱ�÷�Ӧ��ƽ�ⳣ��K=____________��
��4�� һ���������ں��º��ݵ��ܱ������а�һ����������NO(g)��Cl2(g)��ƽ��ʱClNO�����������n(NO)/n(C12)�ı仯ͼ����ͼB����A��B��C��״̬�У�NO��ת����������________�㡣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������о������������к��еĿ�������ʹ������Ѫ�ܸ����ᡣ����������ģ����ͼ��ʾ�������йؿ��������������ȷ���ǣ�������
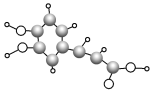
A.������ķ���ʽΪC9H8O4
B.��������Է���������Ӧ����ȥ��Ӧ��������Ӧ���Ӿ۷�Ӧ
C.�������в�������̼ԭ��
D.![]() �ǿ������һ��ͬ���칹�壬1 mol ��������������3 mol NaOH
�ǿ������һ��ͬ���칹�壬1 mol ��������������3 mol NaOH
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com