
����Ŀ��ʮ�Ŵ������Ҫ����Ӯ���챣��ս������ζ�Ŷ���Ⱦ���αȹ�ȥҪ����ߡ�ij������������Һʵ�ַ��硢������λһ���ϵ�װ��ʾ��ͼ���£�����װ�ù���ʱ������˵����ȷ����( )
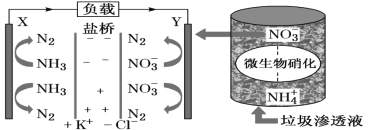
A.������Cl-��Y���ƶ�
B.Y�������ķ�ӦΪ2NO3����10e-��6H2O=N2����12OH-����ΧpH����
C.������X���ص�������Y��
D.��·������7.5mol����ʱ����������״����N2�����Ϊ16.8L
���𰸡�B
��������
���ݴ�����������Һ�����䷢���ʾ��ͼ��֪��װ������ԭ���װ�ã�X�Ǹ���������ʧ���ӵ�������Ӧ��Y�������������õ��ӵĻ�ԭ��Ӧ2 NO3����10e-��6H2O=N2����12OH-�����������������������������������������ӴӸ�������������
A��������������Һ��װ������ԭ���װ�ã���Һ�е�����������������������X���ƶ���A����
B��Y�������������õ��ӵĻ�ԭ��Ӧ��2NO3����10e-��6H2O=N2����12OH-����ΧpH����B��ȷ��
C��������������������Y���ص�������X����C����
D������ܷ�ӦΪ��5NH3��3NO3��=4N2��6H2O��3OH�����÷�Ӧת����15mol���ӣ�����4molN2���ʵ�·������7.5mol����ʱ������2molN2����״�������Ϊ44.8L��D����
��ѡB��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�������Ⱦ��Ĵ������Ի��������������Ⱦ������������������ĵ�����ʮ����Ҫ�����塣
(1)��֪��C(s)+O2(g)�TCO2(g)��H����393.5/kJmol
N2(g)+O2(g)�T2NO(g)��H��+180kJ/mol
��C(s)+2NO(g)�TCO2(g)+N2(g) ����H��_____kJ/mol��
(2)��һ���¶��£���2L�ĺ����ܱ������г���4.0 mol NO2��4.0 mol CO���ڴ��������·�����Ӧ4CO(g)+2NO2(g)4CO2(g)+N2(g)�����������������ʾ��
t/min | 0 | 5 | 10 | 15 | 20 |
n(NO2)/mol | 4.0 | 3.4 | 3.12 | 3.0 | 3.0 |
n(N2)/mol | 0 | 0.30 | 0.44 | 0.50 | 0.50 |
����0��5 min�ڣ���CO2��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ_____��
�ڴ��¶��µĻ�ѧƽ�ⳣ��K�ı���ʽΪ_____��
(3)�û���̿��ԭ��������������йط�ӦΪC(s)+2NO(g)![]() CO2(g)+N2(g)��ij�о�С����2L�ܱ������м��������Ļ���̿��һ������NO�������¶Ⱥ�������䣬����������Ӧ��
CO2(g)+N2(g)��ij�о�С����2L�ܱ������м��������Ļ���̿��һ������NO�������¶Ⱥ�������䣬����������Ӧ��
������������˵��������Ӧ�Ѵ�ƽ�����_____(����)��
A.����̿���������ٱ仯
B.������������ܶȱ��ֲ���
C.2v(NO)�� ��v(N2)��
D. ���ֲ���
���ֲ���
��ѹǿΪpʱ�������Ĵ�Ч�ʡ������������������¶ȵĹ�ϵ��ͼ��ʾ��������������������Ҫȡ�����¶�ʱ����Ӧ���¶ȷ�Χ��_____��
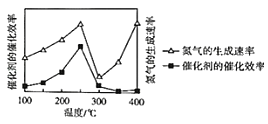
(4)��(N2H4)����ɫҺ�壬����ǿ��ԭ�ԡ�
���µ�ˮ��Һ�������ԣ�����������NH3H2O���ƣ����һ�����뷽��ʽΪ_____��
������N2H4ȼ�ϵ�ز���Ի���û����Ⱦ���õ���Թ���������Ϊ�����(�ܴ���O2��)��д�������ĵ缫��Ӧʽ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�����ǽ���غ���������ˮ����Ĺؼ���������ͼ�ǵ�������������ˮװ�õĹ���ԭ��ʾ��ͼ(�����ڲ�������������������ʾ��ͬ���͵����ӽ���Ĥ)������������b�缫�ϳ�������Cl2�����й��ڸ�װ�õ�˵���������
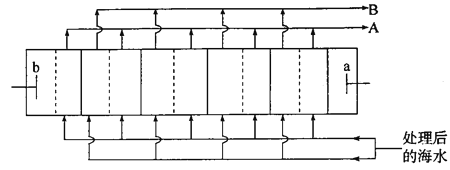
A. ����������b�����Ƹ���a��
B. ��������ʾ�����ӽ���Ĥ����������ʾ�����ӽ���Ĥ
C. ��ˮԤ������Ҫ�dz�ȥCa2����Mg2����
D. A������������Ũˮ����B���������ǵ�ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���鼰�仯������ұ��ҽ�ơ����������о�����Ҫ���á�������Ȼ���еĺ������٣�������������Ϳ������ʽ���ڡ��Ը�ѡ���Ļ������Ҫ�ɷ���Bi2S3����������Bi2O3��SiO2��Cu2S��FeS2�����ʣ�ͨ�������������͵�������������������̣�
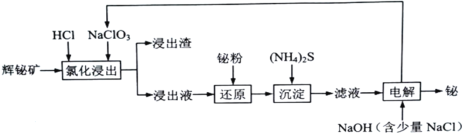
��֪��I.���Ȼ������������У��������μ���NaClO3���Է�����Cl2;
II.BiCl3����ˮ�����ɲ����Ե�BiOCl����������Ũ�����м�����ˮ��;
III.�����ԣ�Fe3+��Cu2+��Bi3+��H+.
��ش��������⣺
(1)���Ȼ�������ʱ��Ϊ����߽�ȡ���ʣ��ɲ�ȡ�Ĵ�ʩ��________________����дһ��������������������ҪĿ����______________________.
(2)�������к���S��____________��д��ѧʽ����
(3)д�����Ȼ���������Bi2S3��������Ӧ�����ӷ���ʽ__________________________.
(4)����ԭ����������������Ӧ�����ӷ���ʽΪ2Bi+3Cu2+=2Bi3++3Cu��____________��
(5)����������̵ļ���װ����ͼ��ʾ��װ����NΪ��Դ��________�����������������������������Ϸ�������Ҫ�缫��ӦʽΪ__________________________��
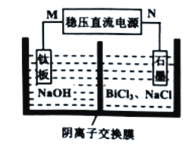
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Fe(CO)5���۵�һ20�棬�е�103�档�������Ʊ�������Fe(CO)5�Ľṹ��ͼ��ʾ��

(1)��̬Feԭ�ӵļ۵����Ų�ʽ��_____________________��Fe(CO)5������������__________���塣
(2)CO������C��Oԭ�Ӷ�����8�����ȶ��ṹ��CO���ӵĽṹʽ��________,д����CO��Ϊ�ȵ�����ķ��ӵĵ���ʽ:___________________��
(3)C��O��Fe�ĵ�һ�������ɴ�С��˳��Ϊ_______________________��
(4)����Fe(CO)5������˵����ȷ����______��
A. Fe(CO)5�ǷǼ��Է��ӣ�CO�Ǽ��Է��� B. Fe(CO)5��Feԭ����sp3�ӻ���ʽ��CO�ɼ�
C.1molFe(CO)5����10mol��λ�� D.Fe(CO)5==Fe+5CO��Ӧ��û���»�ѧ������
(5)�������־���ľ�����Ϊ�������������־���ľ�������ͼ��ʾ��

���������־���ľ������������ľ�������______(�a�����ġ����á�)-Fe��
��a-Fe��������ԭ�ӵ���λ��Ϊ_______________��
�ۦ�-Fe�����ı߳�Ϊapm�����-Fe���ʵ��ܶ�Ϊ____g/cm3(NA��ʾ����٤��������ֵ���г�����ʽ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������أ�KBe2BO3F2���Ǽ������ĺ��IJ��ϣ��ҹ���ѧ���ڴ�������о��������������ǰ�С��ش��������⣺
(1)����������зǽ���Ԫ��ԭ�ӵĵ縺�Դ�С˳����______________����̬K+�ĵ����Ų�ʽΪ__________________��
(2)NaBH4���л��ϳ��г��õĻ�ԭ�������е������ӿռ乹����_______________������ԭ�ӵ��ӻ���ʽΪ__________��NaBH4�д���__________�����ţ���
a.���Ӽ� b.��� c.���� d.����
(3)BeCl2�еĻ�ѧ���������ԵĹ����ԣ�����״̬����˫�۷��Ӵ��ڵ�BeCl2�ĽṹʽΪ_________________��
��4����������Ԫ�ط�������۵����±���
������ | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
�۵�/�� | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
���ͱ��з������۵�仯��ԭ��__________________________��
(5)CaF2��һ�־�����ͼ��ʾ��Ca2+ռ��F-�γɵĿ�϶����r(F-)=x pm��r(Ca2+)=y pm���谢���ӵ�������ֵΪNA����CaF2���ܶ���=____________________g��cm-3���г��������ʽ����
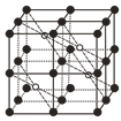
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ĥ���þ������ʢ��50ml����ˮ���ձ�����pH���������Ƕȴ����������Һ��pH����Һ�Ƕ���ʱ��ı仯��ͼ�������й�������ȷ�ģ� ��
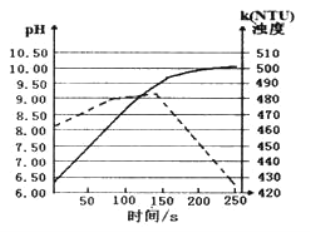
A.��ʵ�����ڳ����½��е�
B.ʵ�߱�ʾ��Һ�Ƕ���ʱ��ı仯
C.50sʱ����Һ�е����̪��Һ����Һ���
D.150s����Һ�Ƕ��½�����Ϊ���ɵ�Mg(OH)2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ƻ���к��е��ۡ������Ǻ����εȣ�ij������ȤС�������һ��ʵ��֤��ijЩ�ɷֵĴ��ڣ�������벢Э������������ʵ�顣
��1����С�Թ�ȡ������ƻ��֭������_______(�����ƣ�����Һ��������֤��ƻ���к��е��ۡ�
��2�����ú����۵����ʿ����������ᡣ�������������������ͼ���Իش��������⣺
![]()
B���ճ���������������ζ�ij����л������Щ�����к���B��
��д����ѧ����ʽ����ע����Ӧ���͡�
B����ᷴӦ:____________________________������______________��Ӧ��
B��C____________________________������____________________________��Ӧ��
�ڿ����ڼ���A���Լ���____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڹż��еļ���˵������ȷ����
A. �����ݸ�Ŀ�����վ�����Ŀ��д����Ԫʱʼ���䷨����Ũ�ƺ�����굣���������������ˮ��ζ��Ũ�ң��Ǿ�¶Ҳ�����������õ���������ָ����
B. �����ϴ���������ࡷ������(��ͭ)�����ᣬ����������� �����˺Ͻ�Ӳ�ȷ��������
C. �����ݾ���ע���й��ڼ�����ʯ(KNO3)������(Na2SO4)�ļ��أ����Ի���֮����������������ʯҲ�����÷���Ӧ������ɫ��Ӧ
D. ������������ƪ���м��أ�����ɰ(HgS)��֮��ˮ���������ֳɵ�ɰ�����ù��̷����˷ֽ⡢���ϡ�������ԭ��Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com