
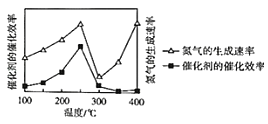
ЁОЬтФПЁПбаОПДѓЦјЮлШОЮяЕФДІРэЃЌЖдЛКНтКЭжЮРэЛЗОГЮлШОЁЂБЃЛЄЮвУЧРЕвдЩњДцЕФЕиЧђЃЌОпгаЪЎЗжживЊЕФвтвхЁЃ
(1)вбжЊЃКC(s)+O2(g)ЈTCO2(g)ЁїHЃНЉ393.5/kJmol
N2(g)+O2(g)ЈT2NO(g)ЁїHЃН+180kJ/mol
дђC(s)+2NO(g)ЈTCO2(g)+N2(g) ЕФЁїHЃН_____kJ/molЁЃ
(2)дквЛЖЈЮТЖШЯТЃЌЯђ2LЕФКуШнУмБеШнЦїжаГфШы4.0 mol NO2КЭ4.0 mol COЃЌдкДпЛЏМСзїгУЯТЗЂЩњЗДгІ4CO(g)+2NO2(g)4CO2(g)+N2(g)ЃЌВтЕУЯрЙиЪ§ОнШчБэЫљЪОЃК
t/min | 0 | 5 | 10 | 15 | 20 |
n(NO2)/mol | 4.0 | 3.4 | 3.12 | 3.0 | 3.0 |
n(N2)/mol | 0 | 0.30 | 0.44 | 0.50 | 0.50 |
Ђйдк0ЁЋ5 minФкЃЌгУCO2ЕФХЈЖШБфЛЏБэЪОЕФЗДгІЫйТЪЮЊ_____ЁЃ
ЂкДЫЮТЖШЯТЕФЛЏбЇЦНКтГЃЪ§KЕФБэДяЪНЮЊ_____ЁЃ
(3)гУЛюадЬПЛЙдЗЈДІРэЕЊбѕЛЏЮяЃЌгаЙиЗДгІЮЊC(s)+2NO(g)![]() CO2(g)+N2(g)ЁЃФГбаОПаЁзщЯђ2LУмБеШнЦїжаМгШызуСПЕФЛюадЬПКЭвЛЖЈСПЕФNOЃЌБЃГжЮТЖШКЭЬхЛ§ВЛБфЃЌЗЂЩњЩЯЪіЗДгІЁЃ
CO2(g)+N2(g)ЁЃФГбаОПаЁзщЯђ2LУмБеШнЦїжаМгШызуСПЕФЛюадЬПКЭвЛЖЈСПЕФNOЃЌБЃГжЮТЖШКЭЬхЛ§ВЛБфЃЌЗЂЩњЩЯЪіЗДгІЁЃ
ЂйЯТСаУшЪіФмЫЕУїЩЯЪіЗДгІвбДяЦНКтЕФЪЧ_____(ЬюБъКХ)ЁЃ
A.ЛюадЬПЕФжЪСПВЛдйБфЛЏ
B.ШнЦїжаЦјЬхЕФУмЖШБЃГжВЛБф
C.2v(NO)е§ ЃНv(N2)Фц
D. БЃГжВЛБф
БЃГжВЛБф
ЂкбЙЧПЮЊpЪБЃЌДпЛЏМСЕФДпЛЏаЇТЪЁЂЕЊЦјЕФЩњГЩЫйТЪгыЮТЖШЕФЙиЯЕШчЭМЫљЪОЁЃЕБЕЊЦјЕФЩњГЩЫйТЪжївЊШЁОігкЮТЖШЪБЃЌЖдгІЕФЮТЖШЗЖЮЇЪЧ_____ЁЃ
(4)ыТ(N2H4)ЪЧЮоЩЋвКЬхЃЌОпгаЧПЛЙдадЁЃ
ЂйыТЕФЫЎШмвКЯдШѕМюадЃЌЦфЕчРыЙ§ГЬгыNH3H2OРрЫЦЃЌдђЕквЛВНЕчРыЗНГЬЪНЮЊ_____ЁЃ
ЂкаТаЭN2H4ШМСЯЕчГиВњЮяЖдЛЗОГУЛгаЮлШОЃЌИУЕчГивдЙЬЬхбѕЛЏЮяЮЊЕчНтжЪ(ФмДЋЕМO2Љ)ЁЃаДГіИКМЋЕФЕчМЋЗДгІЪН_____ЁЃ
ЁОД№АИЁПЉ573.5 0.012mol/ЃЈLminЃЉ KЃН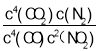 AB 300ЁЋ400Ёц N2H4H2ON2H5++OHЉ N2H4Љ4eЉ+2O2ЉЃНN2Ёќ+2H2O
AB 300ЁЋ400Ёц N2H4H2ON2H5++OHЉ N2H4Љ4eЉ+2O2ЉЃНN2Ёќ+2H2O
ЁОНтЮіЁП
(1)ЁЂвбжЊЃКC(s)+O2(g)ЈTCO2(g)ЁїHЃНЉ393.5kJ/mol
N2(g)+O2(g)ЈT2NO(g)ЁїHЃН+180kJ/mol
гЩИЧЫЙЖЈТЩМЦЫуЂйЉЂкЕУЕНC(s)+2NO(g)ЈTCO2(g)+N2(g) ЃЛ
(2) ЂйЁЂИљОнv=![]() МЦЫуЃЛ
МЦЫуЃЛ
ЂкЁЂИљОнЦНКтГЃЪ§БэДяЪННтД№ЃЛ
(3) ЂйЁЂИљОнЗДгІПЩФцЗДгІДяЕНЦНКтзДЬЌЪБЃЌе§ФцЗДгІЫйТЪЯрЕШ(ЭЌжжЮяжЪ)Лђе§ФцЗДгІЫйТЪжЎБШЕШгкЯЕЪ§жЎБШ(ВЛЭЌЮяжЪ)ЃЌЦНКтЪБИїжжЮяжЪЕФЮяжЪЕФСПЁЂХЈЖШЕШВЛдйЗЂЩњБфЛЏЃЌгЩДЫбмЩњЕФвЛаЉЮяРэСПВЛБфЃЌвдДЫЗжЮіЃЛ
ЂкЁЂЕЊЦјЕФЩњГЩЫйТЪжївЊШЁОігкЮТЖШЪБЃЌЫЕУїДЫЪБвЊАбДпЛЏМСЛюадНЕЕНзюЕЭЛђепДпЛЏаЇТЪЛљБОБЃГжВЛБфЪБЃЌВЂЧвЫцзХЮТЖШЩЯЩ§ЃЌN2ЩњГЩЫйТЪдіМгЃЌЃЛ
(4) ЂйЁЂыТЕФЫЎШмвКЯдШѕМюадЃЌЦфЕчРыЙ§ГЬгыNH3H2OРрЫЦЃЌдђЕквЛВНЕчРыЗНГЬЪНЮЊЃКN2H4H2ON2H5++OHЉЃЈЛђN2H4+H2ON2H5++OHЉЃЉЃЛ
ЂкЁЂШМСЯЕчГиИКМЋЗЂЩњбѕЛЏЗДгІЃЌN2H4зЊЛЏЮЊN2ЃЌОнДЫНтД№ЁЃ
ЃЈ1ЃЉвбжЊЃКЂйCЃЈsЃЉ+O2ЃЈgЃЉЈTCO2ЃЈgЃЉЁїH1ЃНЉ393.5/kJmol
ЂкN2ЃЈgЃЉ+O2ЃЈgЃЉЈT2NOЃЈgЃЉЁїH2ЃН+180kJ/mol
ЫљЧѓЗДгІЮЊЃКCЃЈsЃЉ+2NOЃЈgЃЉЈTCO2ЃЈgЃЉ+N2ЃЈgЃЉЃЌЗДгІПЩгЩЂйЉЂкЕУЕНЃЌИљОнИЧЫЙЖЈТЩЃЌЁїHЃНЁїH1ЉЁїH2ЃНЉ573.5kJ/molЃЌ
ЙЪД№АИЮЊЃКЉ573.5ЃЛ
ЃЈ2ЃЉЂй0ЁЋ5minФкЃЌЁїnЃЈN2ЃЉЃН0.30molЃЌдђvЃЈN2ЃЉЃН![]() ЃН
ЃН![]() ЃН0.003mol/ЃЈLminЃЉЃЌгЩЛЏбЇЗДгІЫйТЪжЎБШЕШгкЛЏбЇМЦСПЪ§жЎБШЃЌдђvЃЈCO2ЃЉЃН4vЃЈN2ЃЉЃН0.012mol/ЃЈLminЃЉЃЌ
ЃН0.003mol/ЃЈLminЃЉЃЌгЩЛЏбЇЗДгІЫйТЪжЎБШЕШгкЛЏбЇМЦСПЪ§жЎБШЃЌдђvЃЈCO2ЃЉЃН4vЃЈN2ЃЉЃН0.012mol/ЃЈLminЃЉЃЌ
ЙЪД№АИЮЊЃК0.012mol/ЃЈLminЃЉЃЛ
ЂкЗДгІЮЊЃК4COЃЈgЃЉ+2NO2ЃЈgЃЉ4CO2ЃЈgЃЉ+N2ЃЈgЃЉЃЌдђДЫЮТЖШЯТЕФЛЏбЇЦНКтГЃЪ§KЕФБэДяЪНЮЊKЃН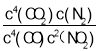 ЃЌЙЪД№АИЮЊЃКKЃН
ЃЌЙЪД№АИЮЊЃКKЃН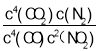 ЃЛ
ЃЛ
ЃЈ3ЃЉЂйAЃЎЛюадЬПВЮМгЛЏбЇЗДгІЃЌЫцзХЗДгІНјааЃЌжЪСПЗЂЩњБфЛЏЃЌДяЕНЛЏбЇЦНКтЪБЃЌЛюадЬПжЪСПВЛБфЃЌЙЪAбЁЃЛ
BЃЎШнЦїжаЦјЬхЕФУмЖШЮЊ![]() ЃЌЗДгІЧАКѓжЪСПЪиКуЃЌЕЋгЩгкгаЙЬЯрЮяжЪВЮгыЃЌЦјЬхжЪСПЛсЗЂЩњИФБфЃЌШнЦїVВЛБфЃЌећИіЙ§ГЬЛьКЯЦјЬхУмЖШИФБфЃЌПЩвдЭЈЙ§УмЖШБфЛЏХаЖЯЛЏбЇЦНКтЃЌЙЪBбЁЃЛ
ЃЌЗДгІЧАКѓжЪСПЪиКуЃЌЕЋгЩгкгаЙЬЯрЮяжЪВЮгыЃЌЦјЬхжЪСПЛсЗЂЩњИФБфЃЌШнЦїVВЛБфЃЌећИіЙ§ГЬЛьКЯЦјЬхУмЖШИФБфЃЌПЩвдЭЈЙ§УмЖШБфЛЏХаЖЯЛЏбЇЦНКтЃЌЙЪBбЁЃЛ
CЃЎЗДгІДяЕНЦНКтЪБЃЌvе§ЃНvФцЃЌгІЮЊv ЃЈNOЃЉе§ЃН2v ЃЈN2ЃЉФцЃЌЙЪCВЛбЁЃЛ
DЃЎN2КЭCO2ЪМжеАД1ЃК1БШР§ЩњГЩЃЌЮоЗЈХаЖЯЛЏбЇЦНКтЃЌЙЪDВЛбЁЃЌ
ЙЪД№АИЮЊЃКAЁЂBЃЛ
ЂкЕЊЦјЕФЩњГЩЫйТЪжївЊШЁОігкЮТЖШЪБЃЌЫЕУїДЫЪБвЊАбДпЛЏМСЛюадНЕЕНзюЕЭЃЌВЂЧвЫцзХЮТЖШЩЯЩ§ЃЌN2ЩњГЩЫйТЪдіМгЃЌЫљвдПЩвдПижЦЮТЖШЕФЗЖЮЇЪЧЃК300ЁЋ400ЁцЃЌ
ЙЪД№АИЮЊЃК300ЁЋ400ЁцЃЛ
ЃЈ4ЃЉЂйыТЕФЫЎШмвКЯдШѕМюадЃЌЦфЕчРыЙ§ГЬгыNH3H2OРрЫЦЃЌдђЕквЛВНЕчРыЗНГЬЪНЮЊЃКN2H4H2ON2H5++OHЉЃЈЛђN2H4+H2ON2H5++OHЉЃЉЃЌ
ЙЪД№АИЮЊЃКN2H4H2ON2H5++OHЉЃЈЛђN2H4+H2ON2H5++OHЉЃЉЃЛ
ЂкШМСЯЕчГиИКМЋЗЂЩњбѕЛЏЗДгІЃЌN2H4зЊЛЏЮЊN2ЃЌЫљвдЕчМЋЗДгІЮЊЃКN2H4Љ4eЉ+2O2ЉЃНN2Ёќ+2H2OЃЌ
ЙЪД№АИЮЊЃКN2H4Љ4eЉ+2O2ЉЃНN2Ёќ+2H2OЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПN2ЃЋ3H2![]() 2NH3КЯГЩАБЙЄвЕЖдЛЏбЇЙЄвЕКЭЙњЗРЙЄвЕОпгаживЊвтвхЁЃЙЄвЕКЯГЩАБЩњВњЪОвтЭМШчЭМЫљЪОЁЃ
2NH3КЯГЩАБЙЄвЕЖдЛЏбЇЙЄвЕКЭЙњЗРЙЄвЕОпгаживЊвтвхЁЃЙЄвЕКЯГЩАБЩњВњЪОвтЭМШчЭМЫљЪОЁЃ
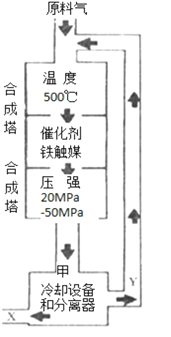
ЂйXЕФЛЏбЇЪНЮЊ___ЃЛ
ЂкЭМжаЬѕМўбЁЖЈЕФжївЊдвђЪЧЃЈбЁЬюзжФИађКХЃЉ___ЃЛ
AЃЎЮТЖШЁЂбЙЧПЖдЛЏбЇЦНКтгАЯь
BЃЎЬњДЅУНдкИУЮТЖШЪБЛюадДѓ
CЃЎЙЄвЕЩњВњЪмЖЏСІЁЂВФСЯЁЂЩшБИЕШЬѕМўЕФЯожЦ
ЂлИФБфЗДгІЬѕМўЃЌЛсЪЙЦНКтЗЂЩњвЦЖЏЁЃШчЭМБэЪОЫцЬѕМўИФБфЃЌАБЦјЕФАйЗжКЌСПЕФБфЛЏЧїЪЦЁЃЕБКсзјБъЮЊбЙЧПЪБЃЌБфЛЏЧїЪЦе§ШЗЕФЪЧЃЈбЁЬюзжФИДњКХЃЉ___ЃЌЕБКсзјБъЮЊЮТЖШЪБЃЌБфЛЏЧїЪЦе§ШЗЕФЪЧЃЈбЁЬюзжФИађКХЃЉ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкФГКуЮТКуШнЕФУмБеШнЦїФкЗЂЩњЗДгІЃК2AЃЈgЃЉ+BЃЈgЃЉ![]() CЃЈgЃЉЁїHЃМ0ЁЃПЊЪМГфШы2mol AКЭ2mol BЃЌВЂДяЕНЦНКтзДЬЌЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
CЃЈgЃЉЁїHЃМ0ЁЃПЊЪМГфШы2mol AКЭ2mol BЃЌВЂДяЕНЦНКтзДЬЌЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. дйГфШы2mol AЃЌЦНКте§вЦЃЌAЕФзЊЛЏТЪдіДѓ
B. ШчЙћЩ§ИпЮТЖШЃЌCЕФЬхЛ§ЗжЪ§діДѓ
C. ШчЙћдіДѓбЙЧПЃЌЛЏбЇЦНКтвЛЖЈЯђе§ЗДгІЗНЯђвЦЖЏЃЌBЕФЬхЛ§ЗжЪ§МѕаЁ
D. дйГфШы1mol CЃЌCЕФЮяжЪЕФСПХЈЖШНЋдіДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
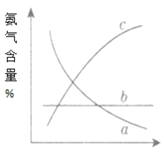
ЁОЬтФПЁПдквЛЖЈЮТЖШЯТЕФУмБеШнЦїжаЃЌПЩФцЗДгІN2 + 3H2![]() 2NH3 ДяЕНЦНКтзДЬЌЕФБъжОЪЧ
2NH3 ДяЕНЦНКтзДЬЌЕФБъжОЪЧ
A. N2ЁЂH2ЁЂNH3дкШнЦїжаЙВДц
B. ЛьКЯЦјЬхЕФзмЮяжЪЕФСПВЛдйЗЂЩњБфЛЏ
C. ЕЅЮЛЪБМфФкЩњГЩn mol N2ЃЌЭЌЪБЩњГЩ3n mol H2
D. ЕЅЮЛЪБМфФкЯћКФn mol N2ЃЌЭЌЪБЯћКФn mol NH3
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбЧТШЫсФЦ(NaClO2)ЪЧвЛжжживЊЕФКЌТШЯћЖОМСЁЃвдЯТЪЧЙ§бѕЛЏЧтЗЈЩњВњбЧТШЫсФЦЕФЙЄвеСїГЬЭМЃЌгаЙиЫЕЗЈВЛе§ШЗЕФЪЧ(ЁЁЁЁ)
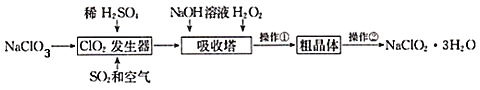
A.NaOHЕФЕчзгЪНЮЊ![]()
B.МгШыЕФH2O2Ц№бѕЛЏзїгУ
C.ClO2ЗЂЩњЦїжаЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ2ClO3Љ+SO2 ЈT2ClO2+SO42Љ
D.ВйзїЂкЪЕбщЗНЗЈЪЧжиНсОЇ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯуРМЫиЪЧживЊЕФЯуСЯжЎвЛЃЌЫќПЩгЩЖЁЯуЗгОЖрВНЗДгІКЯГЩЃЎ
гаЙиЩЯЪіСНжжЛЏКЯЮяЕФЫЕЗЈе§ШЗЕФЪЧ(ЁЁЁЁ)
A.ГЃЮТЯТЃЌ1 molЖЁЯуЗгжЛФмгы1 mol Br2ЗДгІ
B.ЖЁЯуЗгВЛФмгыFeCl3ШмвКЗЂЩњЯдЩЋЗДгІ
C.ЯуРМЫиЗжзгжазюЖрга12ИідзгЙВЦНУц
D.1 molЯуРМЫизюЖрФмгы4 molЧтЦјЗЂЩњМгГЩЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаБэЪОЕЊдзгНсЙЙЕФЛЏбЇгУгяжа,ЖдКЫЭтЕчзгдЫЖЏзДЬЌУшЪіе§ШЗЧвФмОнДЫШЗЖЈЕчзгФмМЖЕФЪЧЃЈ ЃЉ
A.![]() B.
B.![]() C.1s22s22p3D.
C.1s22s22p3D.![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаХаЖЯе§ШЗЕФЪЧ(NAБэЪОАЂЗќМгЕТТоГЃЪ§)ЃЈ ЃЉ
A.ГЃЮТc(OHЃ)/c(H+)=10-13ЕФШмвКжаПЩФмКЌгаK+ЁЂFe2+ЁЂNO3ЃЁЂClЃЫФжжРызг
B.1 L 0.1molL-1ЕФCH3COONaШмвКжаCH3COOЃКЭOHЃЕФзмЪ§Дѓгк0.1NA
C.ЕчзгЙЄвЕЩЯгУ30%ЕФТШЛЏЬњШмвКИЏЪДЗѓдкгЁЫЂЯпТЗАхЩЯЕФЭВЃКFe3+ +Cu = Fe2++Cu2+
D.H2ЕФШМЩеШШЮЊa kJЁЄmolЃ1ЃЌH2ШМЩеШШЕФШШЛЏбЇЗНГЬЪНЮЊЃКO2(g) +2H2(g) = 2H2O(l) ІЄH = Ѓ2a kJЁЄmolЃ1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЎОХДѓБЈИцжаЬсГівЊЁАДђгЎРЖЬьБЃЮРеНЁБЃЌвтЮЖзХЖдЮлШОЗРжЮБШЙ§ШЅвЊЧѓИќИпЁЃФГжжРћгУРЌЛјЩјЭИвКЪЕЯжЗЂЕчЁЂЛЗБЃЖўЮЛвЛЬхНсКЯЕФзАжУЪОвтЭМШчЯТЃЌЕБИУзАжУЙЄзїЪБЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ( )
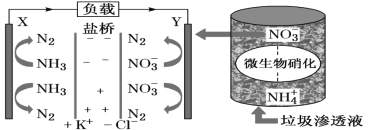
A.бЮЧХжаCl-ЯђYМЋвЦЖЏ
B.YМЋЗЂЩњЕФЗДгІЮЊ2NO3ЃЃЋ10e-ЃЋ6H2O=N2ЁќЃЋ12OH-ЃЌжмЮЇpHдіДѓ
C.ЕчСїгЩXМЋбиЕМЯпСїЯђYМЋ
D.ЕчТЗжаСїЙ§7.5molЕчзгЪБЃЌЙВВњЩњБъзМзДПіЯТN2ЕФЬхЛ§ЮЊ16.8L
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com