
【题目】香兰素是重要的香料之一,它可由丁香酚经多步反应合成.
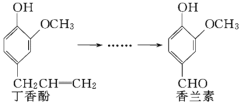
有关上述两种化合物的说法正确的是( )
A.常温下,1 mol丁香酚只能与1 mol Br2反应
B.丁香酚不能与FeCl3溶液发生显色反应
C.香兰素分子中最多有12个原子共平面
D.1 mol香兰素最多能与4 mol氢气发生加成反应
科目:高中化学 来源: 题型:
【题目】哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。
N2+3H2![]() 2NH3
2NH3
现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,下列有关说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置制备Cl2并检验其性质,下列说法正确的是( )
A.I图中:如果MnO2过量,浓盐酸就可全部消耗完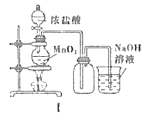
B.II图中:用排饱和食盐水收集一试管氯气,充分光照后,水槽中溶液酸性增强,量筒中液面上升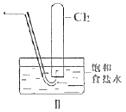
C.III图中:生成蓝色的烟,若向集气瓶中加入少量水,所得溶液呈黄色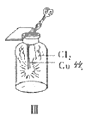
D.IV图中:干燥的有色布条不褪色,湿润的有色布条能褪色,说明Cl2有漂白性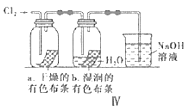
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是

A. 反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH>0
2NO2(g)的ΔH>0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D. 380℃下,c起始(O2)=5.0×104 mol·L1,NO平衡转化率为50%,则平衡常数K>2000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气污染物的处理,对缓解和治理环境污染、保护我们赖以生存的地球,具有十分重要的意义。
(1)已知:C(s)+O2(g)═CO2(g)△H=﹣393.5/kJmol
N2(g)+O2(g)═2NO(g)△H=+180kJ/mol
则C(s)+2NO(g)═CO2(g)+N2(g) 的△H=_____kJ/mol。
(2)在一定温度下,向2L的恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g)4CO2(g)+N2(g),测得相关数据如表所示:
t/min | 0 | 5 | 10 | 15 | 20 |
n(NO2)/mol | 4.0 | 3.4 | 3.12 | 3.0 | 3.0 |
n(N2)/mol | 0 | 0.30 | 0.44 | 0.50 | 0.50 |
①在0~5 min内,用CO2的浓度变化表示的反应速率为_____。
②此温度下的化学平衡常数K的表达式为_____。
(3)用活性炭还原法处理氮氧化物,有关反应为C(s)+2NO(g)![]() CO2(g)+N2(g)。某研究小组向2L密闭容器中加入足量的活性炭和一定量的NO,保持温度和体积不变,发生上述反应。
CO2(g)+N2(g)。某研究小组向2L密闭容器中加入足量的活性炭和一定量的NO,保持温度和体积不变,发生上述反应。
①下列描述能说明上述反应已达平衡的是_____(填标号)。
A.活性炭的质量不再变化
B.容器中气体的密度保持不变
C.2v(NO)正 =v(N2)逆
D. 保持不变
保持不变
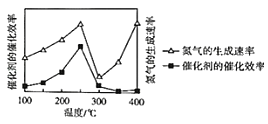
②压强为p时,催化剂的催化效率、氮气的生成速率与温度的关系如图所示。当氮气的生成速率主要取决于温度时,对应的温度范围是_____。
(4)肼(N2H4)是无色液体,具有强还原性。
①肼的水溶液显弱碱性,其电离过程与NH3H2O类似,则第一步电离方程式为_____。
②新型N2H4燃料电池产物对环境没有污染,该电池以固体氧化物为电解质(能传导O2﹣)。写出负极的电极反应式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)难溶物PbSO4溶于CH3COONH4溶液可制得易溶于水的(CH3COO)2Pb,发生的反应为PbSO4+2CH3COONH4=CH3COO)2Pb+(NH4)2SO4,说明(CH3COO)2Pb是___(填“强”或“弱”)电解质。
(2)已知次磷酸(H3PO2)与足量的氢氧化钠溶液反应生成NaH2PO2和H2O,则次磷酸是___元酸(填“一”、“二”或“三”)。
(3)工业上制玻璃和水泥需用到的共同原料是___ (填名称)。
(4)Fe(OH)3胶体可用作净水剂,取少量Fe(OH)3胶体于试管中,向试管中逐渐滴加稀盐酸至过量,产生的现象为___。
(5)已知:5NH4NO3![]() 2HNO3+4N2↑+9H2O,则该反应中氧化产物与还原产物的质量比为___。
2HNO3+4N2↑+9H2O,则该反应中氧化产物与还原产物的质量比为___。
(6)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C进行解毒。下列叙述正确的是___ (填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+氧化为Fe2+ D.亚硝酸盐是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是以苯酚为主要原料制取冬青油和阿司匹林的过程:
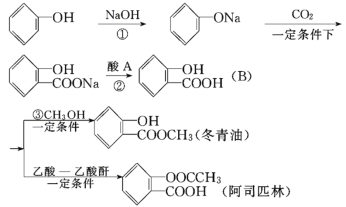
(1) 冬青油含有的官能团名称为________________
(2)B溶于冬青油致使产品不纯,加入下列哪种试剂后再分液即可除去_____
(A) NaOH 溶液 (B) Na2CO3溶液 (C) NaHCO3溶液 (D) Na
(3)写出第①步反应的化学方程式_________________________________.
(4)写出反应③的化学方程式_____________________________________
(5)1 mol 阿司匹林最多可与________ mol 氢氧化钠发生反应.
(6)化合物M是冬青油的同分异构体,与冬青油具有相同的官能团,能与氯化铁发生显色反应,苯环上有两个对位的取代基,写出两种M可能的结构简式____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A. 向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B. 向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C. 0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D. 0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中非金属元素原子的电负性大小顺序是______________。基态K+的电子排布式为__________________。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是_______________,中心原子的杂化方式为__________。NaBH4中存在__________(填标号)。
a.离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为_________________。
(4)第三周期元素氟化物的熔点如下表:
化合物 | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
熔点/℃ | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
解释表中氟化物熔点变化的原因:__________________________。
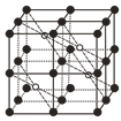
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,若r(F-)=x pm,r(Ca2+)=y pm,设阿伏加德罗常数的值为NA,则CaF2的密度ρ=____________________g·cm-3(列出计算表达式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com