
【题目】在一定温度下的密闭容器中,可逆反应N2 + 3H2![]() 2NH3 达到平衡状态的标志是
2NH3 达到平衡状态的标志是
A. N2、H2、NH3在容器中共存
B. 混合气体的总物质的量不再发生变化
C. 单位时间内生成n mol N2,同时生成3n mol H2
D. 单位时间内消耗n mol N2,同时消耗n mol NH3
科目:高中化学 来源: 题型:
【题目】已知A与![]() 、CO形成B,B能发生银镜反应,C分子中只有一种氢,相关物质转化关系如下
、CO形成B,B能发生银镜反应,C分子中只有一种氢,相关物质转化关系如下![]() 含有相同官能团的有机物通常具有相似的化学性质
含有相同官能团的有机物通常具有相似的化学性质![]() :
:
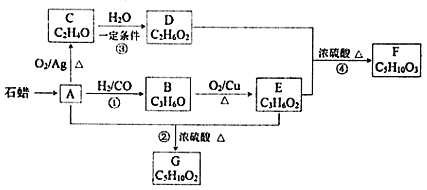
请回答:
![]() 有机物C的结构简式是______,反应②的反应类型是______。
有机物C的结构简式是______,反应②的反应类型是______。
![]() 写出一定条件下发生反应①的化学方程式______。
写出一定条件下发生反应①的化学方程式______。
![]() 下列说法不正确的是______
下列说法不正确的是______![]() 填字母
填字母![]() 。
。
A.化合物A属于烃
B.化合物D含有两种官能团
C.用金属钠无法鉴别化合物F、G
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸(H2C2O4)是一种二元弱酸,草酸及其盐广泛用于医药、印染、塑料等工业。
(1)已知25℃时,几种常见弱酸的Ka如下表所示:
电解质 | H2C2O4 | CH3COOH | HCN | H2CO3 |
电离常数(mol·L-1) | K1=5.6×10-2 K2=5.4×10-3 | K1=1.7×10-5 | K2=6.2×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
①25℃时,浓度均为0.1mol·L-1的Na2C2O4、CH3COONa、NaCN、Na2CO3的pH由大到小的顺序是___。中和等体积、等pH的HCOOH和HCN消耗NaOH的量___(填“前者大”“后者大”或“相等”)。
②下列关于0.1mol·L-1NaHC2O4溶液的说法正确的是___。
a.HC2O4-的电离程度大于水解程度,溶液显酸性
b.HC2O4-的水解程度大于电离程度程度,溶液显碱性
c.溶液中c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
d.溶液中c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
(2)在t℃时,MgC2O4在水中的沉淀溶解平衡曲线如图1所示。又知t℃时Mg(OH)2的Ksp=5.6×10-12,下列说法不正确的是____
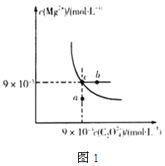
A.在t℃时,MgC2O4的Ksp=8.1×10-5mol2·L-2
B.在MgC2O4饱和溶液中加入Na2CO3固体,可使溶液由c点到b点
C.图中a点对应的是MgC2O4的不饱和溶液
D.在t℃时,MgC2O4(s)+2OH-(aq)Mg(OH)2(s)+C2O42-(aq)平衡常数K=![]()
(3)草酸亚铁晶体(FeC2O4·2H2O)是一种浅黄色固体,难溶于水,受热易分解。某化学兴趣小组设计实验验证草酸亚铁晶体热分解的产物,探究过程如图2:
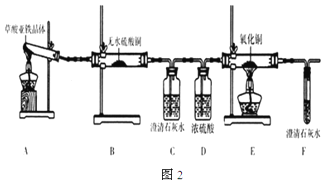
①从环保角度考虑,该套实验装置的明显缺陷是___。
②该兴趣小组进行上述实验时,从实验安全角度考虑,应先点燃___(填“A”或“E”)处的酒精灯。
③若实验过程中观察到B中白色无水CuSO4变成蓝色,___(补充实验现象),则可证明草酸亚铁晶体热分解的气体产物是H2O、CO和
④为探究草酸亚铁晶体分解的固体产物,兴趣小组同学准确称取3.60g草酸亚铁晶体(FeC2O4·2H2O),相对分子质量是180),充分加热,使其完全分解,冷却后称得剩余固体的质量为1.60g。若剩余固体只有一种铁的氧化物,通过计算确定该氧化物的化学式为___。草酸亚铁晶体分解的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置制备Cl2并检验其性质,下列说法正确的是( )
A.I图中:如果MnO2过量,浓盐酸就可全部消耗完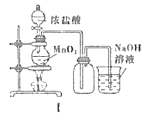
B.II图中:用排饱和食盐水收集一试管氯气,充分光照后,水槽中溶液酸性增强,量筒中液面上升
C.III图中:生成蓝色的烟,若向集气瓶中加入少量水,所得溶液呈黄色
D.IV图中:干燥的有色布条不褪色,湿润的有色布条能褪色,说明Cl2有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.30mol/L.下列有关判断正确的是
zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.30mol/L.下列有关判断正确的是
A. C的体积分数增大了 B. A的转化率降低了
C. 平衡向正反应方向移动 D. x+y<z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是

A. 反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH>0
2NO2(g)的ΔH>0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D. 380℃下,c起始(O2)=5.0×104 mol·L1,NO平衡转化率为50%,则平衡常数K>2000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气污染物的处理,对缓解和治理环境污染、保护我们赖以生存的地球,具有十分重要的意义。
(1)已知:C(s)+O2(g)═CO2(g)△H=﹣393.5/kJmol
N2(g)+O2(g)═2NO(g)△H=+180kJ/mol
则C(s)+2NO(g)═CO2(g)+N2(g) 的△H=_____kJ/mol。
(2)在一定温度下,向2L的恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g)4CO2(g)+N2(g),测得相关数据如表所示:
t/min | 0 | 5 | 10 | 15 | 20 |
n(NO2)/mol | 4.0 | 3.4 | 3.12 | 3.0 | 3.0 |
n(N2)/mol | 0 | 0.30 | 0.44 | 0.50 | 0.50 |
①在0~5 min内,用CO2的浓度变化表示的反应速率为_____。
②此温度下的化学平衡常数K的表达式为_____。
(3)用活性炭还原法处理氮氧化物,有关反应为C(s)+2NO(g)![]() CO2(g)+N2(g)。某研究小组向2L密闭容器中加入足量的活性炭和一定量的NO,保持温度和体积不变,发生上述反应。
CO2(g)+N2(g)。某研究小组向2L密闭容器中加入足量的活性炭和一定量的NO,保持温度和体积不变,发生上述反应。
①下列描述能说明上述反应已达平衡的是_____(填标号)。
A.活性炭的质量不再变化
B.容器中气体的密度保持不变
C.2v(NO)正 =v(N2)逆
D. 保持不变
保持不变
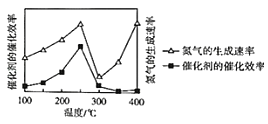
②压强为p时,催化剂的催化效率、氮气的生成速率与温度的关系如图所示。当氮气的生成速率主要取决于温度时,对应的温度范围是_____。
(4)肼(N2H4)是无色液体,具有强还原性。
①肼的水溶液显弱碱性,其电离过程与NH3H2O类似,则第一步电离方程式为_____。
②新型N2H4燃料电池产物对环境没有污染,该电池以固体氧化物为电解质(能传导O2﹣)。写出负极的电极反应式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是以苯酚为主要原料制取冬青油和阿司匹林的过程:
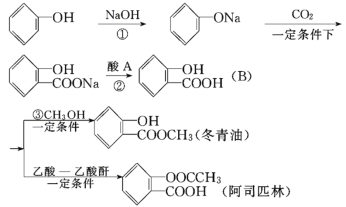
(1) 冬青油含有的官能团名称为________________
(2)B溶于冬青油致使产品不纯,加入下列哪种试剂后再分液即可除去_____
(A) NaOH 溶液 (B) Na2CO3溶液 (C) NaHCO3溶液 (D) Na
(3)写出第①步反应的化学方程式_________________________________.
(4)写出反应③的化学方程式_____________________________________
(5)1 mol 阿司匹林最多可与________ mol 氢氧化钠发生反应.
(6)化合物M是冬青油的同分异构体,与冬青油具有相同的官能团,能与氯化铁发生显色反应,苯环上有两个对位的取代基,写出两种M可能的结构简式____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋及其化合物在冶金、医疗、化工生产中均有重要作用。铋在自然界中的含量极少,常以游离金属和矿物的形式存在。对浮选过的辉铋矿(主要成分是Bi2S3,还含少量Bi2O3、SiO2、Cu2S、FeS2等杂质)通过浸出、净化和电沉积法分离回收铋的流程:
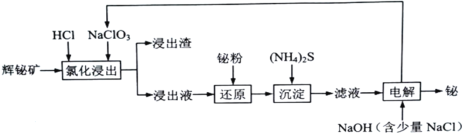
已知:I.“氯化浸出”过程中,需分批多次加入NaClO3,以防生成Cl2;
II.BiCl3极易水解生成不溶性的BiOCl沉淀,但在浓盐酸中几乎不水解;
III.氧化性:Fe3+>Cu2+>Bi3+>H+.
请回答以下问题:
(1)“氯化浸出”时,为了提高浸取速率,可采取的措施有________________(任写一条);加入过量盐酸的主要目的是______________________.
(2)浸出渣中含有S和____________(写化学式);
(3)写出“氯化浸出”中Bi2S3所发生反应的离子方程式__________________________.
(4)“还原”过程中所发生反应的离子方程式为2Bi+3Cu2+=2Bi3++3Cu及____________。
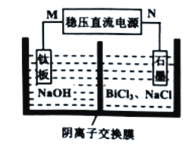
(5)“电解”过程的简易装置如图所示。装置中N为电源的________(填“正”或“负”)极;阳极上发生的主要电极反应式为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com