
����Ŀ������Ӧ�úʹ��������Ļ����������������������Ҫ���塣�ش���������:
(1)�����������������£�������ƫ������[(CH3)2NNH2]�ɿ��ٷ�Ӧ��ƫ������ת��ΪCH3OH��N2���÷�Ӧ�Ļ�ѧ����ʽΪ______________________________��
(2)����������(H2N2O2)��һ�ֶ�Ԫ�ᣬ��������N2O���塣25��ʱ������������ĵ��볣��Ka1��6.17��10-8��Ka2��2.88��10-12
��25��ʱ0.1molL-1NaHN2O2��Һ������Ũ���ɴ�С��˳��Ϊ____________________________��
��25��ʱ��0.1 molL-1������������Һ����ε���NaOH��Һ������Һ��pH��10ʱ��C(N2O22-)/ C(H2N2O2)=________��
(3)�������ȿ���NO��Cl2��Ӧ�Ƶã���Ӧԭ��Ϊ2NO(g)+ Cl2 (g)![]() 2C1NO(g)����Ͷ�ϱ�n(NO)��n(Cl2) ��2:1��NO��Cl2����һ��ѹ���ܱ������з���������Ӧ��NO��ƽ��ת�������¶�T�Ĺ�ϵ��ͼ��ʾ��
2C1NO(g)����Ͷ�ϱ�n(NO)��n(Cl2) ��2:1��NO��Cl2����һ��ѹ���ܱ������з���������Ӧ��NO��ƽ��ת�������¶�T�Ĺ�ϵ��ͼ��ʾ��
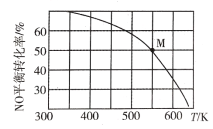
�ٸ÷�Ӧ����H_____(����������������������)0��
��M��ʱ������NO���������Ϊ____��
������Ӧһֱ������Pѹǿ�����½��У���M���ƽ�ⳣ��Kp=____________��(�ú�P�ı���ʽ��ʾ)��
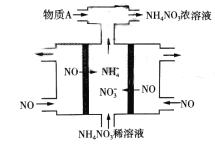
(4)��ҵ�ϵ��NO�Ʊ�NH4NO3���Ա��Ϊ�����乤��ԭ����ͼ��ʾ�����ʱ������ӦʽΪ___________,Ϊʹ������ȫ��ת��ΪNH4NO3����Ҫ��������A������A��ѧʽΪ__________��
���𰸡�2Cl2 + 2H2O + (CH3)2NNH2 = 2CH3OH + N2 + 4HCl c(Na+) > c(HN2O2��) > c(OH��) > c(H+) > c(N2O22��) 17.8 < 40% ![]() NO �� 3e�� +2 H2O = 4H+ +NO3�� NH3
NO �� 3e�� +2 H2O = 4H+ +NO3�� NH3
��������
(1)������ƫ������[(CH3)2NNH2]�ɿ��ٷ�Ӧ����CH3OH��N2�����ᣬ����������ԭ��Ӧд����Ӧ�Ļ�ѧ����ʽ��
(2)��25��ʱ0.1molL-1NaHN2O2��Һˮ�ⳣ�������ƽ�ⳣ���Ƚϣ�ˮ��ռ��Ҫ���ó�����Ũ���ɴ�С��˳����25��ʱ��0.1 molL-1������������Һ����ε���NaOH��Һ������Һ��pH��10ʱ������ƽ�ⳣ����˵ó���
(3)����ͼ�������¶ȣ�ת���ʼ�С��ƽ�������ƶ������������ȷ�Ӧ����n(NO)��n(Cl2) ��2:1������n(NO) ��2mol��n(Cl2) ��1mol��M��ʱNOת����Ϊ50%������ʽ������ϵ����ó���������ͱ�ʾ��ѹǿƽ�ⳣ����
(4)����ʾ��ͼ�������仯NO �� NO3��������NO �� NH4+�����ݵ缫��Ӧ����ʽ��д�������������ʻ�����ƽ�⣬�����·��������ת�Ƶ�����Ŀ���ʱ��������n(NO3��) > n(NH4+)������Ҫʹ������ȫ��ת��ΪNH4NO3���ó���Ҫ��������ʡ�
(1)������ƫ������[(CH3)2NNH2]�ɿ��ٷ�Ӧ����CH3OH��N2�����ᣬ��Ӧ�Ļ�ѧ����ʽΪ 2Cl2 + 2H2O + (CH3)2NNH2 = 2CH3OH + N2 + 4HCl���ʴ�Ϊ��2Cl2 + 2H2O + (CH3)2NNH2 = 2CH3OH + N2 + 4HCl��
(2)��25��ʱ0.1molL-1NaHN2O2��Һˮ�ⳣ��![]() ��ˮ��ռ��Ҫ����Һ�Լ��ԣ��������Ũ���ɴ�С��˳��Ϊc(Na+) > c(HN2O2��) > c(OH��) > c(H+) > c(N2O22��)���ʴ�Ϊ��c(Na+) > c(HN2O2��) > c(OH��) > c(H+) > c(N2O22��)��
��ˮ��ռ��Ҫ����Һ�Լ��ԣ��������Ũ���ɴ�С��˳��Ϊc(Na+) > c(HN2O2��) > c(OH��) > c(H+) > c(N2O22��)���ʴ�Ϊ��c(Na+) > c(HN2O2��) > c(OH��) > c(H+) > c(N2O22��)��
��25��ʱ��0.1 molL-1������������Һ����ε���NaOH��Һ������Һ��pH��10ʱ����![]() ��
��![]() ���ʴ�Ϊ��17.8��
���ʴ�Ϊ��17.8��
(3)����ͼ�������¶ȣ�ת���ʼ�С��ƽ�������ƶ������������ȷ�Ӧ��������ȷ�Ӧ���÷�Ӧ����H �� 0���ʴ�Ϊ������
��n(NO)��n(Cl2) ��2:1������n(NO) ��2mol��n(Cl2) ��1mol��M��ʱNOת����Ϊ50%��
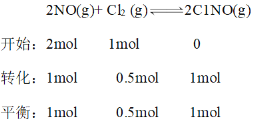
M��ʱ������NO���������Ϊ![]() ����Ϊ40%��
����Ϊ40%��
������Ӧһֱ������Pѹǿ�����½��У���M���ƽ�ⳣ��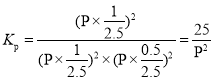 ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(4)����ʾ��ͼ�������仯NO �� NO3��������NO �� NH4+�����ݵ缫��Ӧ����ʽ��д�������������ʻ�����ƽ�⣬������д��������������ʽ�ֱ�Ϊ��NO + 5e�� + 6 H+ = H2O + NH4+��NO �� 3e�� +2 H2O = 4H+ +NO3���������·��������ת�Ƶ�����Ŀ���ʱ������n(NO3��) > n(NH4+)������Ҫʹ������ȫ��ת��ΪNH4NO3����Ҫ����NH3�������ӷ�Ӧ����NH4+���ʴ�Ϊ��NO �� 3e�� +2 H2O = 4H+ +NO3����NH3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50mL0.50molL��1������50mL0.55molL��1NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��ش��������⣺
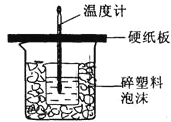
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ���������������_________________��
��2���ձ���������ֽ����������___________________________________________________________��
��3�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ_______������ƫ��ƫС����Ӱ��������
��4�������60mL 0.50molL��1������50mL 0.55molL��1NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������_________��������ȡ�����������������к���_______��������ȡ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NaClO2)��һ����Ҫ�ĺ����������������ǹ������ⷨ�����������ƵĹ�������ͼ���й�˵������ȷ����(����)
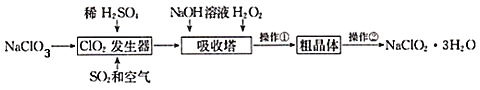
A.NaOH�ĵ���ʽΪ![]()
B.�����H2O2����������
C.ClO2�������з�����Ӧ�����ӷ���ʽΪ2ClO3��+SO2 �T2ClO2+SO42��
D.������ʵ�鷽�����ؽᾧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾ��ԭ�ӽṹ�Ļ�ѧ������,�Ժ�������˶�״̬������ȷ���ܾݴ�ȷ�������ܼ����ǣ� ��
A.![]() B.
B.![]() C.1s22s22p3D.
C.1s22s22p3D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����BH3Ϊƽ��������(���Ǿ�Ϊ120��)��NH3Ϊ������(����Ϊ107.3��)����֪��������ͬ�����������ƵĽṹ���ɴ��ƶϣ��ټ����ڼ�̼������(![]() )���ۼ�̼������(
)���ۼ�̼������(![]() )�ļ�����Դ�С˳��Ϊ(����)
)�ļ�����Դ�С˳��Ϊ(����)
A.�ڣ��٣���B.�٣��ڣ���
C.�ۣ��٣���D.�٣��ڣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ж���ȷ����(NA��ʾ�����ӵ�����)�� ��
A.����c(OH��)/c(H+)=10-13����Һ�п��ܺ���K+��Fe2+��NO3����Cl����������
B.1 L 0.1molL-1��CH3COONa��Һ��CH3COO����OH������������0.1NA
C.���ӹ�ҵ����30%���Ȼ�����Һ��ʴ����ӡˢ��·���ϵ�ͭ����Fe3+ +Cu = Fe2++Cu2+
D.H2��ȼ����Ϊa kJ��mol��1��H2ȼ���ȵ��Ȼ�ѧ����ʽΪ��O2(g) +2H2(g) = 2H2O(l) ��H = ��2a kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ľ���Ϊ���������ѻ�����ͼ��ʾ�����ԭ�ӵ�ֱ��Ϊd����NA��ʾ�����ӵ���������������ĸ�����ĶԽ����ϣ�3����ԭ�ӱ˴��������У�M��ʾ���Ħ��������������˵���������(����)

A.����ÿ�������к���4����ԭ��
B.�����������ԣ�����ԭ�Ӿ����ܲ�ȡ�ܶѻ�
C.һ�������������16![]() d3
d3
D.������ܶ���![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У����Ѵﵽ��ѧƽ��ķ�Ӧ��![]() ��������ӦΪ���ȷ�Ӧ���������������䣬������˵����ȷ��һ����
��������ӦΪ���ȷ�Ӧ���������������䣬������˵����ȷ��һ����
�����º��������£����벻���뷴Ӧ������He��ƽ�ⲻ�ƶ�����������������������
�����º�ѹ�����£����벻���뷴Ӧ������He��ƽ�������ƶ������֪x>3
�����������£�����ϵ���£�����Ӧ���ʺ��淴Ӧ���ʶ������淴Ӧ��������ö�Щ
�����������£�����ϵ���£���������ƽ����Է�������һ������
���ı�ijһ������ʹƽ�������ƶ�����Ӧ��A��ת����һ������
����ѹѹ�����������ƽ���������ƶ������������ƶ�����C��D������һ�ֱ�Ϊ����̬
���ı�ijһ������ֻҪƽ�������ƶ������淴Ӧ����һ����С
A.�٢ۢ�B.�ڢܢ�C.�ڢۢ�D.�ۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(H3AsO3)�����������ư�Ѫ��,����Һ�д��ڶ�������̬����1L0.1mol��L-1H3AsO3��Һ����μ���KOH��Һ�����������ʵ�����������Һ��pH ��ϵ����ͼ��ʾ������˵����ȷ���ǣ� ��
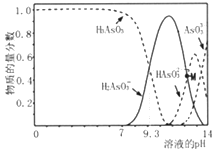
A. H3AsO3�ĵ��볣��Ka1��������Ϊ10-9
B. pH��8.0��10.0ʱ,��Ӧ�����ӷ���ʽ��H3AsO3+OH-=H2AsO3-+H2O
C. M���Ӧ����Һ�У�c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1mol��L-1
D. pH=12ʱ,��Һ�У�c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com