
【题目】下表离子组中所给离子在水溶液中能大量共存,且当加入试剂后反应的离子方程式书 写正确的是( )
离子组 | 加入试剂 | 发生反应的离子方程式 | |
A |
| NaOH溶液 |
|
B |
| BaCl2溶液 |
|
C |
| 少量KOH溶液 |
|
D |
| 通入少量SO2 |
|
A.AB.BC.CD.D
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
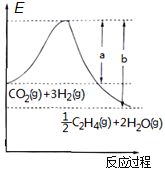
【题目】乙烯是重要的化工原料。用CO2催化加氢可制取乙烯:CO2(g)+3H2(g)![]()
![]() C2H4(g)+2H2O(g) ΔH<0
C2H4(g)+2H2O(g) ΔH<0
(1)若该反应体系的能量随反应过程变化关系如图所示,则该反应的△H=__kJ/mol。(用含a、b的式子表示)
(2)几种化学键的键能如表所示,实验测得上述反应的△H=-76kJ/mol,则表中的x=__。
化学键 | C=O | H—H | C=C | C—H | H—O |
键能/kJ·mol-1 | x | 436 | 612 | 414 | 464 |
(3)向1L恒容密闭容器中通入1molCO2和nmolH2,在一定条件下发生上述反应,测得CO2的转化率α(CO2)与反应温度T、压强P的关系如图所示。
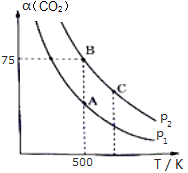
①P1___P2(填“>”、“<”或“=”,下同)。
②平衡常数KB__KC。
③若B点时投料比![]() =3,则平衡常数KB=__(代入数据列出算式即可,不用化简)。
=3,则平衡常数KB=__(代入数据列出算式即可,不用化简)。
④其他条件不变时,能同时满足增大反应速率和提高CO2转化率的措施是___。
A.将产物从体系不断分离出去 B.给体系升温
C.给体系加压 D.增大H2的浓度
(4)①以稀硫酸为电解质溶液,利用太阳能电池将CO2转化为乙烯的工作原理如图所示。则M极上的电极反应式为___。
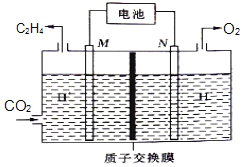
②已知乙烯也能做燃料电池,当消耗标况下2.24L乙烯时,导线中转移电子的数目为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某石油化工产品X的转化关系如图,下列判断不正确的是( )
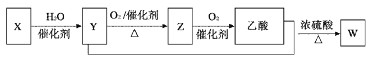
A. X可以发生加聚反应B. Y能与钠反应产生氢气
C. Z与CH3OCH3互为同分异构体D. W的结构简式为CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是(NA表示阿伏加德罗常数)( )
A.常温c(OH-)/c(H+)=10-13的溶液中可能含有K+、Fe2+、NO3-、Cl-四种离子
B.1 L 0.1molL-1的CH3COONa溶液中CH3COO-和OH-的总数大于0.1NA
C.电子工业上用30%的氯化铁溶液腐蚀敷在印刷线路板上的铜箔:Fe3+ +Cu = Fe2++Cu2+
D.H2的燃烧热为a kJ·mol-1,H2燃烧热的热化学方程式为:O2(g) +2H2(g) = 2H2O(l) ΔH = -2a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知

A. X、Y、Z中最简单氢化物稳定性最弱的是Y
B. Z元素氧化物对应水化物的酸性一定强于Y
C. X元素形成的单核阴离子还原性大于Y
D. Z元素单质在化学反应中只表现氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系一定正确的是( )
A.25℃时,pH均为10的氨水与 Ba(OH)2 溶液中,溶质的物质的量浓度之比为1:2
B.某温度下,0.1mol·L1 NaHCO3溶液的pH=8,则 c(OH)=106mol·L1
C.0.1mol·L1的HA溶液的pH=2,溶液中c(H+)=c(OH)+c(A)
D.pH=9的CH3COONa溶液与pH=9的氨水中,水电离出的c(OH)之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小
B. 乙烯与溴加成反应的产物为溴乙烷
C. 1 mol苯恰好与3 mol氢气完全加成,说明苯分子中有三个碳碳双键
D. 当n=7,主链上有5个碳原子的烷烃共有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,其原子均满足8e-结构。写出其电子式_________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阴极区与生成的氯气反应产生少量三氯化氮,该反应的化学方程式为_______。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0 mol/L NaOH溶液充分反应放出的热量如下表所示:
反应 序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量 /kJ |
1 | 0.5 | 0.75 | a |
2 | 1.0 | 2.00 | b |
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为:_______。
(3)利用CO可以将NO转化为无害的N2,其反应为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为300 ℃、T ℃、300 ℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g)+2CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为300 ℃、T ℃、300 ℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(CO)(甲容器)/mol | 2.0 | 1.5 | 1.1 | 0.8 | 0.8 |
n(CO)(乙容器)/mol | 2.0 | 1.45 | 1.0 | 1.0 | 1.0 |
n(CO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=________。
②该反应的ΔH________0(填“>”或“<”)。
③丙容器达到平衡时,CO的转化率为________。
(4)如图是在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯的原理模型。

①太阳能电池的负极是________。(填“a”或“b”)
②生成丙烯的电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤脱硫的反应为2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) △H<0。500℃时,实验测得在2L刚性密闭容器中该反应在不同时刻O2、CO2的物质的量(或物质的量浓度)如下表所示,下列判断正确的是( )
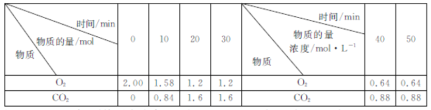
A.0~10min内,平均反应速率v(SO2)=0.084mol·L-1·min-1
B.30min后,改变的条件只能是增大O2的通入量
C.若容器绝热,则20min时,![]() >
>![]()
D.化学平衡常数:30min<40min
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com