
| A. | 6种 | B. | 7种 | C. | 13种 | D. | 16种 |
分析 有机物A的分子式为C9H10O2,不饱和度为$\frac{2×9+2-10}{2}$=5,其水解后产物可以使FeCl3溶液变紫色,说明生成物中含有酚,则分子内含一个苯环、属于酯,故含有苯环、酯基,结合取代基的不同分析同分异构体;
解答 解:有机物A的分子式为C9H10O2,不饱和度为$\frac{2×9+2-10}{2}$=5,其水解后产物可以使FeCl3溶液变紫色,说明生成物中含有酚,则分子内含一个苯环、属于酯;
若含有1个取代基,取代基为:-OOCCH2CH3,只有1种同分异构体;
若含有2个取代基,取代基为:-OOCCH3和-CH3;-OOCH和-CH2CH3,2个取代基分为邻、间、对三种结构,有6种同分异构体;
若含有3个取代基,取代基为:-OOCH和-CH3,-CH3,二甲苯有邻、间、对3种结构,用-OOCH分别取代苯环上的1个氢原子,则分别有2种、3种、1种,共有6种同分异构体;
所以A的同分异构体有13种,
故选C.
点评 本题考查同分异构体的书写,题目难度不大,判断取代基是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 只由非金属元素组成的离子不一定都是阴离子 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 某元素从化合态变为游离态,该元素一定被还原 | |
| D. | 金属元素原子最外层电子数越少,金属性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (10b-5a)mol•L- | B. | (2b-a)mol•L- | C. | ($\frac{b}{10}$-$\frac{a}{20}$)mol•L- | D. | (5b-$\frac{5a}{2}$)mol•L- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
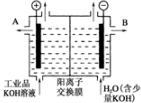
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L氧气含有n1个O2,则NA为4n | |
| B. | 2.4g金属镁与足量的盐酸反应,转移电子数为2NA | |
| C. | 常温下,22.4LSO2所含的分子数为NA | |
| D. | 18g水中所含的分子数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①④ | C. | ②③ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
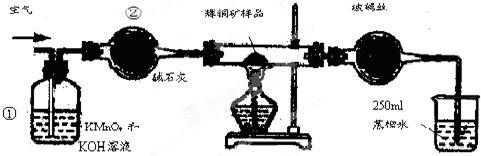
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
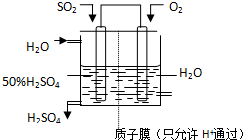
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com