
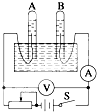
 如图所示为电解水的装置,闭合开关S后,观察到电压表示数为6.0V,电流表示数为100mA.
如图所示为电解水的装置,闭合开关S后,观察到电压表示数为6.0V,电流表示数为100mA.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.
Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、降低温度,使平衡正向移动 |
| B、体积不变充入N2使压强增大 |
| C、体积不变充入He使气体压强增大 |
| D、保持总压强不变,充入Ne气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
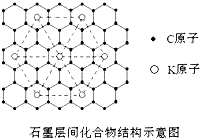 铁合金中常含有碳,铁、碳材料在日常生活、工业生产和科学研究中具有极其重要的用途.回答以下问题:
铁合金中常含有碳,铁、碳材料在日常生活、工业生产和科学研究中具有极其重要的用途.回答以下问题:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com