
【题目】(1)相对分子质量为84的烃与氢气加成后得到 ,该烃的名称为______。
,该烃的名称为______。
(2)某气态烃22.4L(标准状况)与含320 g溴的溴水恰好完全加成,生成物经测定每个碳原子上都有1个溴原子,该烃的结构简式为______。
(3)某烃0.1 mol和0.2 mol HCl完全加成,生成的氯代烷最多还可以与0.6mol氯气反应,则该烃的结构简式为______。
(4)某烃的分子式为C8H10,它不能使溴水褪色,但能使酸性KMnO4溶液褪色。该有机物苯环上的一氯代物有3种,则该烃的结构简式可能为______。
(5)3.4g多元醇A在氧气中完全燃烧时生成CO2和H2O分别为0.125 mol和0.15mol,如将该多元醇的任意一个羟基换成一个卤原子,所得到的卤代物都只有一种,该醇的结构简式为_____。
【答案】3,3—二甲基—1—丁烯 CH2=CH—CH=CH2 CH≡C—CH3 ![]() 、
、 C(CH2OH)4
C(CH2OH)4
【解析】
(1)烯烃加氢得到烷烃,则烷烃分子中相邻碳原子上各去掉1个氢原子,则变成相应的烯烃。(2)22.4L(标准状况)气态烃的物质的量是1mol,320 g溴的物质的量是2mol,生成物每个碳原子上都有1个溴原子,则生成物是 ,逆推可知原烃的结构简式;(3)某烃0.1 mol和0.2 mol HCl完全加成,生成的氯代烷最多还可以与0.6mol氯气反应,说明原烃分子含有1个叁键或2个双键,含有4个氢原子,根据
,逆推可知原烃的结构简式;(3)某烃0.1 mol和0.2 mol HCl完全加成,生成的氯代烷最多还可以与0.6mol氯气反应,说明原烃分子含有1个叁键或2个双键,含有4个氢原子,根据![]() ,可知分子式为
,可知分子式为![]() ;(4)某烃的分子式为C8H10,它不能使溴水褪色,但能使酸性KMnO4溶液褪色。则该有机物可能是乙苯、邻二甲苯、间二甲苯、对二甲苯,乙苯苯环上的一氯代物有3种、邻二甲苯苯环上的一氯代物有2种,间二甲苯苯环上的一氯代物有3种,对二甲苯苯环上的一氯代物有1种。(5)3.4g多元醇A在氧气中完全燃烧时生成CO2和H2O分别为0.125 mol和0.15mol,则C、H原则的物质的量分别是0.125mol、0.3mol, 3.4g醇中O的物质的量为=(3.40-0.125×12-0.300×1)/16g/mol=0.100mol,该醇C:H:O=5:12:4,最简式为C5H12O4,将该多元醇的任意一个羟基换成一个卤原子,所得到的卤代物都只有一种,说明分子中-OH的化学环境都相同。
;(4)某烃的分子式为C8H10,它不能使溴水褪色,但能使酸性KMnO4溶液褪色。则该有机物可能是乙苯、邻二甲苯、间二甲苯、对二甲苯,乙苯苯环上的一氯代物有3种、邻二甲苯苯环上的一氯代物有2种,间二甲苯苯环上的一氯代物有3种,对二甲苯苯环上的一氯代物有1种。(5)3.4g多元醇A在氧气中完全燃烧时生成CO2和H2O分别为0.125 mol和0.15mol,则C、H原则的物质的量分别是0.125mol、0.3mol, 3.4g醇中O的物质的量为=(3.40-0.125×12-0.300×1)/16g/mol=0.100mol,该醇C:H:O=5:12:4,最简式为C5H12O4,将该多元醇的任意一个羟基换成一个卤原子,所得到的卤代物都只有一种,说明分子中-OH的化学环境都相同。
(1)烯烃加氢得到烷烃,则烷烃分子中相邻碳原子上各去掉1个氢原子,则变成相应的烯烃,烯烃的结构简式是 ,根据烯烃命名原则,该烃的名称为3,3—二甲基—1—丁烯。(2)22.4L(标准状况)气态烃的物质的量是1mol,320 g溴的物质的量是2mol,生成物每个碳原子上都有1个溴原子,则生成物是
,根据烯烃命名原则,该烃的名称为3,3—二甲基—1—丁烯。(2)22.4L(标准状况)气态烃的物质的量是1mol,320 g溴的物质的量是2mol,生成物每个碳原子上都有1个溴原子,则生成物是 ,逆推可知原烃是1,3-丁二烯,结构简式是CH2=CH—CH=CH2;(3)某烃0.1 mol和0.2 mol HCl完全加成,生成的氯代烷最多还可以与0.6mol氯气反应,说明原烃分子含有1个叁键或2个双键,含有4个氢原子,根据
,逆推可知原烃是1,3-丁二烯,结构简式是CH2=CH—CH=CH2;(3)某烃0.1 mol和0.2 mol HCl完全加成,生成的氯代烷最多还可以与0.6mol氯气反应,说明原烃分子含有1个叁键或2个双键,含有4个氢原子,根据![]() ,可知分子式为
,可知分子式为![]() ,结构简式是CH≡C—CH3;(4)某烃的分子式为C8H10,它不能使溴水褪色,但能使酸性KMnO4溶液褪色。则该有机物可能是乙苯、邻二甲苯、间二甲苯、对二甲苯,乙苯苯环上的一氯代物有3种、邻二甲苯苯环上的一氯代物有2种,间二甲苯苯环上的一氯代物有3种,对二甲苯苯环上的一氯代物有1种。所以该烃为乙苯或间二甲苯,结构简式为
,结构简式是CH≡C—CH3;(4)某烃的分子式为C8H10,它不能使溴水褪色,但能使酸性KMnO4溶液褪色。则该有机物可能是乙苯、邻二甲苯、间二甲苯、对二甲苯,乙苯苯环上的一氯代物有3种、邻二甲苯苯环上的一氯代物有2种,间二甲苯苯环上的一氯代物有3种,对二甲苯苯环上的一氯代物有1种。所以该烃为乙苯或间二甲苯,结构简式为![]() 、
、 ;(5)3.4g多元醇A在氧气中完全燃烧时生成CO2和H2O分别为0.125 mol和0.15mol,则C、H原则的物质的量分别是0.125mol、0.3mol, 3.4g醇中O的物质的量为=(3.40-0.125×12-0.300×1)/16g/mol=0.100mol,该醇C:H:O=5:12:4,最简式为C5H12O4,将该多元醇的任意一个羟基换成一个卤原子,所得到的卤代物都只有一种,说明分子中-OH的化学环境都相同,所以该醇的结构简式为C(CH2OH)4。
;(5)3.4g多元醇A在氧气中完全燃烧时生成CO2和H2O分别为0.125 mol和0.15mol,则C、H原则的物质的量分别是0.125mol、0.3mol, 3.4g醇中O的物质的量为=(3.40-0.125×12-0.300×1)/16g/mol=0.100mol,该醇C:H:O=5:12:4,最简式为C5H12O4,将该多元醇的任意一个羟基换成一个卤原子,所得到的卤代物都只有一种,说明分子中-OH的化学环境都相同,所以该醇的结构简式为C(CH2OH)4。


科目:高中化学 来源: 题型:
【题目】目前,对碳、氮及化合物的研究备受关注。已知:
I.2C(s)+2NO(g)![]() N2(g)+2CO(g)
N2(g)+2CO(g) ![]() =-414.8kJ/mol
=-414.8kJ/mol
II.2CO(g)+O2(g)![]() 2CO2 (g)
2CO2 (g)![]() =-566kJ/mol
=-566kJ/mol
III.2CO(g)+2NO(g)![]() N2(g)+2CO2 (g)
N2(g)+2CO2 (g)![]() =-759.8kJ/mol
=-759.8kJ/mol
回答下列问题:
(l) N2的电子式为 ___ 。
(2)表示碳的燃烧热的热化学方程式为____。
(3)某催化剂的M型、N型均可催化反应2CO(g)+O2 (g)=2CO2 (g)。向容积相同的恒容密闭容器中分别充入等量的CO和O2,在相同时间段内,不同温度下测得CO的转化率(a)如图所示。

①由图推断下列说法正确的是 ___(填选项字母)。
A.a、b、c、d点均达到平衡状态B.该反应的平衡常数K(b)=K(c)
C.b点反应物的有效碰撞几率最大D.图中五个点对应状态下,a点反应速率最慢
②e点CO的转化率突然减小的可能原因为_______________________
③若b点容器中c(O2)=0.5 mol·L-l,则To℃时该反应的平衡常数K=________
(4) T1℃时,向刚性容器中充入2 mol NO和2 mol CO,发生反应Ⅲ。5 min时达到平衡状态,测得容器中n(N2) =0.8 mol、c(CO2)=0. 32 mol/L。
①0~5 min内,用NO表示的反应速率v(NO)=_________
②反应进行到2 min时,v正(CO) ___v逆(CO2)(填“>”“<”或“=”)。
③若升高温度,容器内气体压强____(填“增大”“减小”或“不变”),原因为 ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用作食品添加剂(抗结剂),我国卫生部规定实验中黄血盐的最大使用量为10mg/kg。一种制备黄雪盐的工艺如下:

回答下列问题:
(1)步骤Ⅰ反应的化学方程式为__________________________。
(2)步骤Ⅳ过滤所得的废液中含量较多的溶质为____________(填化学式)。
(3)步骤Ⅴ所用的试剂X是___________。(填化学式)
(4)工艺中用到剧毒的HCN溶液,含CN- 的废水必须处理后才能排放。
已知: HCN是一种具有苦杏仁味的无色剧毒液体,易挥发,25℃时Ka(HCN)=6.25×10-10;溶液中H2CO3、HCO3-、CO32-的存在与溶液pH的关系如图所示:
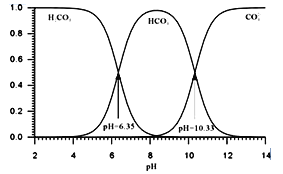
①NaCN的电子式为___________。
②处理含CN-废水的方法:第一步控制pH>10,用NaClO溶液先将CN-不完全氧化为OCN-;第二步控制pH为7.5~8.5,用NaClO溶液完全氧化OCN-生成N2和两种盐。第一步控制强碱性的主要目的是_______,第二步反应的离子方程式为____________。
(5)已知蓝色染料普鲁士蓝的合成方法如下:

用硫酸亚铁碱性试纸可以检验食品中是否含有CN-,方案如下:

若试纸变蓝则证明食品中含有CN-,基于普鲁士蓝的合成原理,请解释检测时试纸变蓝的原因:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实或操作不符合平衡移动原理的是( )
A. 开启啤酒有泡沫逸出
B. H2、I2、HI平衡混合气加压后颜色变深
C. 装有NO2的烧瓶置于热水中颜色加深
D. 实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中,A为空气中常见的气体单质,B、C、E是金属单质,D为非金属单质。已知:①I是一种常见的温室气体,E原子核内有12个质子;②反应![]() 能放出大量的热,该反应曾应用于铁轨的焊接。回答下列问题:
能放出大量的热,该反应曾应用于铁轨的焊接。回答下列问题:

(1)分别写出A、F的化学式
A________;F ________。
(2)写出下列反应的化学方程式
C+G![]() B+H______________
B+H______________
2E+I![]() 2F+D_____________
2F+D_____________
(3)C与NaOH溶液反应的离子方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】云南是南方丝绸之路的重要节点,有着丰富的铜镍矿石资源。回答下列相关问题:
(1)镍在元素周期表中的位置是____,其基态原子的电子排布式为_____,该原子核外有___个未成对电子。
(2)Ni(NH3)4SO4中N的杂化轨道类型是_____;1 mol Ni(NH3)42+中含有的![]() 键数目为____个;SO42-的立体构型是______。
键数目为____个;SO42-的立体构型是______。

(3)氨是_____分子(填“极性”或“非极性”),经测定NH4F为分子晶体,类比NH3·H2O表示出NH4F分子中的氢键_____。
(4)铜镍合金的立方晶胞结构如图所示,其中原子A的坐标参数为(0,1,0);
①原子B的坐标参数为____;
②若该晶体密度为dg/cm3,则铜镍原子间最短距离为____pm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。同温下将等质量的氢气与氦气同时充入容器,符合实际情况的是( )
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.酯的水解反应和酯化反应都属于取代反应
B.乙烯能使溴水褪色,发生氧化反应
C.乙醇不能被酸性高锰酸钾溶液氧化
D.葡萄糖不能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)CO2的重整用CO2和H2为原料可得到CH4燃料。
已知:①CH4(g)+CO2(g)=2CO(g)+2H2(g)△H1=+247kJ/mol
②CH4(g)+H2O(g)=CO(g)+3H2(g)△H2=+205kJ/mol
则CO2重整的热化学方程式为______。
(2)“亚硫酸盐法”吸收烟中的SO2,将烟气通入1.0mol/L的Na2SO3溶液,若此过程中溶液体积不变,则溶液的pH不断______(填“减小”、“不变”或“增大)。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂,此时溶液中c(SO32-)=0.2mol/L,则溶液中c(HSO3-)=______;
(3)催化还原法去除NO.一定条件下,用NH3消除NO污染,其反应原理:4NH3+6NO![]() 5N2+6H2O.不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:1、3:1、1:3时,得到NO脱除率曲线如图1所示。
5N2+6H2O.不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:1、3:1、1:3时,得到NO脱除率曲线如图1所示。
①随温度升高NO脱除率下降的原因是______;
②曲线a中,NO的起始浓度为6×10-4mgm-3,从A点到B点经过0.8s,该时间段内NO的脱除速率为______mgm-3s-1;
③曲线b对应NH3与NO的物质的量之比是______。
(4)间接电化学法除NO.其原理如图2所示:写出阴极的电极反应式(阴极室溶液呈酸性)______;
吸收池中除去NO的离子方程式为______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com