
【题目】将一定质量的Mg-Al合金投入到100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液至过量,生成沉淀质量与加入NaOH溶液的体积关系如下图所示。 求:

(1)写出20ml-160ml阶段的离子反应方程式 ;
(2)160ml-180ml阶段的离子反应方程式 ;
(3)原合金分别与足量的稀硫酸和氢氧化钠溶液反应产生气体的在同温同压下的体积比为___________。
(4)HCl的物质的量浓度为 mol/L。
【答案】(1) Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓
(2)Al(OH)3+OH-=AlO2-+2H2O
(3)7:3(4)8
【解析】
试题分析:根据图片知,0~20mL时没有沉淀生成,说明此时发生的反应为酸碱中和反应O H++OH-=H2O,20~160mL时随着NaOH的加入沉淀的量逐渐增加,此时发生的反应为Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,160~180mL时,随着NaOH的增加,沉淀的量减少,说明发生反应Al(OH)3+OH-=AlO2-+2H2O,所以m[Al(OH)3]=(19.4-11.6)g=7.8g,n[Al(OH)3]=7.8g÷78g/mol=0.1mol,n[Mg(OH)2]=11.6g÷58g/mol=0.2mol.
(1)根据以上分析可知20ml~160ml阶段的离子反应方程式为Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓;
(2)根据以上分析可知160ml~180ml阶段的离子反应方程式为Al(OH)3 + OH- = AlO2- + 2H2O;
(3)根据Mg原子守恒得n(Mg)=n[Mg(OH)2]=0.2mol,根据Al原子守恒得n(Al)=n[Al(OH)3]=0.1mol,与足量稀硫酸反应生成氢气是0.2mol+0.15mol=0.35mol;与足量氢氧化钠溶液反应时镁不反应,则产生的氢气是0.15mol,所以原合金分别与足量的稀硫酸和氢氧化钠溶液反应产生气体的在同温同压下的体积比为0.35mol:0.15mol=7:3;
(4)160mL时,溶液中的溶质为NaCl,根据原子守恒得n(NaCl) = n(HCl) = n(NaOH) = 0.16L × 5 mol/L = 0.8mol,c(HCl) = 0.8mol ÷ 0.1L = 8mol/L。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊进入患者腹中。明胶是水溶性蛋白质混合物,溶于水形成胶体。由工业明胶制成的胶囊往往含有超标的重金属Cr,从而对人体造成伤害。
①已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是 价。
②CrO2-是一种酸根离子,则Fe(CrO2)2属于__ _(填“酸”、“碱”、“盐”或“氧化物”)。
③明胶的水溶液和K2SO4溶液共同具备的性质是 。
A.都不稳定,密封放置会产生沉淀
B.两者均有丁达尔现象
C.分散质粒子都可通过滤纸
Ⅱ.Cr是一种银白色金属,化学性质稳定,以+3和+6价为常见价态。工业上以铬铁矿(主要成分为FeO·Cr2O3 ,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知Na2Cr2O7是一种强氧化剂),其主要工艺流程如下:
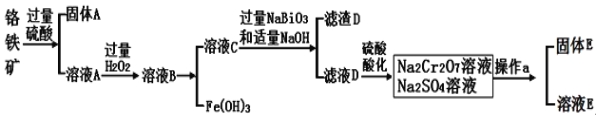
查阅资料:
常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-
(1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式 。
(2)酸化滤液D时,用硫酸而不选用盐酸,可能的原因是 。
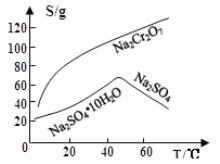
(3)固体E的主要成分是Na2SO4,根据下图分析操作a为 、 。
(4)已知含+6价铬的污水会污染环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用还原沉淀法,具体流程如下:

①Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为 ;(用离子方程式表示)
②下列溶液中可以代替上述流程中Na2S2O3溶液的是 (填选项序号);
A.FeSO4溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.Na2SO3溶液
③上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发生反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某短周期元素X,其原子的电子层数为n,最外层电子数为2n+1。下列有关元素X的说法错误的是( )
A. 元素X不可能是金属元素
B. 元素X的气态氢化物不一定是电解质
C. 元素X一定能形成化学式为KXO3的含氧酸钾盐
D. 工业上制取X的单质时一定采用氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭气缸中,用一不漏气的滑动活塞隔开。常温时,左边充入1/4体积的N2,右边充入3/4体积的H2和O2的混合气。若右边气体点燃,反应后恢复到原温度,活塞停留在气缸正中,则原来混合气中H2和O2的体积比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),进行反应,2SO2(g)+O2(g)![]() 2SO3(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是
2SO3(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是

A.甲中反应的平衡常数小于乙B.该温度下,该反应的平衡常数K为400
C.SO2的平衡转化率:a1>a2=a3D.容器中S03的物质的量浓度:丙=丁<甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随后,婷婷与爸妈探讨环境保护的话题。下列对环境产生污染的行为是( )
A.生活垃圾分类处理
B.收集废旧电池进行无害化处理
C.减少SO2和CO2的排放
D.广泛使用不能降解的塑料包装袋
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是常规核裂变产物之一,可以通过测定大气或水中
是常规核裂变产物之一,可以通过测定大气或水中![]() 的含量变化来监测核电站是否发生放射性物质泄漏。下列有关
的含量变化来监测核电站是否发生放射性物质泄漏。下列有关![]() 的叙述中错误的是
的叙述中错误的是
A. ![]() 的化学性质与
的化学性质与![]() 相同 B.
相同 B. ![]() 的原子序数为53
的原子序数为53
C. ![]() 的原子核外电子数为78 D.
的原子核外电子数为78 D. ![]() 的原子核内中子数多于质子数
的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。请用相关的化学术语回答下列问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA[ | 0 |
2 | ⑤ | ⑥ | ⑦ | |||||
3 | ① | ③ | ④ | ⑧ | ⑨ | |||
4 | ② |
(1) 在这些元素中,最不活泼的是 非金属性最强的是___________,金属性最强的是___________;(填元素符号或化学式,下同。)
(2) 这些元素形成的最高价氧化物对应的水化物中碱性最强的 ,酸性最强的__________;
(3) ①、②、③、④、⑤这五种元素的原子半径由大到小的顺序为 ;
(4) ⑥的氢化物的电子式为 ,① 在空气中燃烧后生成产物的电子式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com