
 2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有 mol A,此时C的物质的量浓度为 。
2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有 mol A,此时C的物质的量浓度为 。科目:高中化学 来源:不详 题型:填空题
 2SO3(g) △H=-190 kJ·mo1-1
2SO3(g) △H=-190 kJ·mo1-1| A.4 mo1SO2和2mol O2 | B.6mol SO2和6mo1 O2 |
| C.4mol SO2和4 mo1 O2 | D.6mo1 SO2和4 mo1 O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 Ni(CO)4(g)△H1<0
Ni(CO)4(g)△H1<0 Ni(S)+4CO(g) △H2
Ni(S)+4CO(g) △H2 
 Ni(OH)2+M 电池充电时,阳极的电极反应式为 。电池充电时阴极上发生 (填“氧化”或“还原”)反应
Ni(OH)2+M 电池充电时,阳极的电极反应式为 。电池充电时阴极上发生 (填“氧化”或“还原”)反应查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
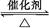 2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·(L·s)-1,则这段时间为( )
2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·(L·s)-1,则这段时间为( )| A.0.1 s | B.2.5 s | C.10 s | D.5 s |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
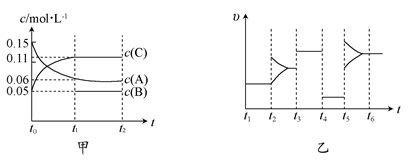
 xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是( )
xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是( )

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
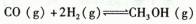

| A.反应达平衡后,升高温度,平衡常数K增大。 |
| B.反应过程中使用Cu2O/ZnO作催化剂,二者均不参加反应。 |
C.500℃反应达到平衡时,用氢气物质的量浓度减少表示该反应的反应速率是: |
| D.300℃反应达到平衡后,若其他条件不变,将体积缩小到原来的1/2,平衡右移,氢气物质的量浓度增大。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.在溶液中存在化学平衡I2(aq) + I-(aq)  I3-(aq),其平衡常数表达式为 I3-(aq),其平衡常数表达式为 |
| B.第2组实验进行18s后,由于I2(g)不断生成导致I3-浓度下降。 |
| C.3-18s内第2组实验中生成I3-的平均反应速率约为0.55 mol/(L·s) |
| D.Fe2+可作为O3氧化I-的催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
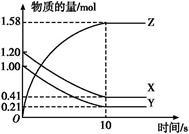
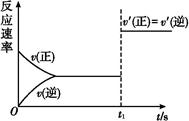
| A.t1时刻,增大了X的浓度 | B.t1时刻,升高了体系温度 |
| C.t1时刻,缩小了容器体积 | D.t1时刻,使用了催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com