
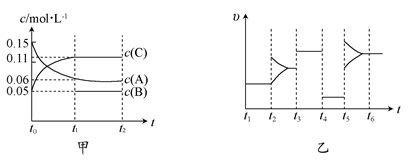
 2C(g)��B(g)����H����100a kJ��mol��1
2C(g)��B(g)����H����100a kJ��mol��1 2C(g)��B(g)����B����ʼŨ��Ϊ0.05��0.03��0.02(mol��L��1)��
2C(g)��B(g)����B����ʼŨ��Ϊ0.05��0.03��0.02(mol��L��1)�� 2C(g)��B(g)
2C(g)��B(g)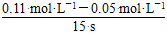 ��0.004 mol��L��1��s��1
��0.004 mol��L��1��s��1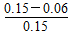 ��100%��60%��
��100%��60%��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
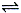 B(g) +C(g)���ݻ�Ϊ1.0L���ܱ������н��У�A�ij�ʼŨ��Ϊ0.050mol/L���¶�T1��T2��A��Ũ����ʱ���ϵ��ͼ��ʾ���ش��������⣺
B(g) +C(g)���ݻ�Ϊ1.0L���ܱ������н��У�A�ij�ʼŨ��Ϊ0.050mol/L���¶�T1��T2��A��Ũ����ʱ���ϵ��ͼ��ʾ���ش��������⣺
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 pZ(g)+qQ(g),ʽ��m��n��p��qΪ��ѧ����������0~3 min��,���������ʵ����ı仯���±���ʾ:
pZ(g)+qQ(g),ʽ��m��n��p��qΪ��ѧ����������0~3 min��,���������ʵ����ı仯���±���ʾ:| �� ���� ʱ�䡡 | X | Y | Z | Q |
| ��ʼ/mol | 0.7 | | 1 | |
| 2 minĩ/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3 minĩ/mol | | | 0.8 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2C(g),�����2 s��,����A��ƽ������Ϊ0.06 mol��L-1��s-1,����2 sʱ,�������� mol A,��ʱC�����ʵ���Ũ��Ϊ ��
2C(g),�����2 s��,����A��ƽ������Ϊ0.06 mol��L-1��s-1,����2 sʱ,�������� mol A,��ʱC�����ʵ���Ũ��Ϊ ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
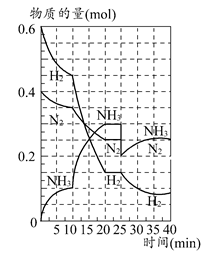
 2NH3��ƽ�ⳣ��K����ֵΪ________�������¶Ȳ��䣬��Ӧ������25 minʱ����ȥ0.1 mol������ʱƽ�ⳣ��K��________(�������С�����䡱)������������䣬�ﵽ��ƽ��������Ӧ�Ļ�ѧ��Ӧ���ʱ�ԭƽ��״̬________(���С�����䡱)��
2NH3��ƽ�ⳣ��K����ֵΪ________�������¶Ȳ��䣬��Ӧ������25 minʱ����ȥ0.1 mol������ʱƽ�ⳣ��K��________(�������С�����䡱)������������䣬�ﵽ��ƽ��������Ӧ�Ļ�ѧ��Ӧ���ʱ�ԭƽ��״̬________(���С�����䡱)���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CH3OH(g) ��H=akJ/mol���ݻ��̶���2L�ܱ������г���2mol CO(g)��4molH2(g)������Ӧ���ⶨ�ڲ�ͬ�¶ȡ���ͬʱ����CO��ת�������±���
CH3OH(g) ��H=akJ/mol���ݻ��̶���2L�ܱ������г���2mol CO(g)��4molH2(g)������Ӧ���ⶨ�ڲ�ͬ�¶ȡ���ͬʱ����CO��ת�������±���
| A���Ȼ�ѧ����ʽ��a��0 |
| B��T1���£��ڵ�һСʱ����H2��ʾ�Ļ�ѧ��Ӧ����Ϊ0��4mol/(L��h) |
| C��T1���£��÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ25 |
| D��T2���£���1=��2��80% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��v(NH3)��0.01 mol��L��1��s��1 | B��v(O2)��0.001 mol��L��1��s��1 |
| C��v(NO)��0.001 mol��L��1��s��1 | D��v(H2O)��0.045 mol��L��1��s��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 4NO+6H2O������Ӧ���ʷֱ���v(NH3)��v(O2)��v(NO)��v(H2O) ��mol/(L��min)�ݱ�ʾ������ȷ�Ĺ�ϵʽ��( )
4NO+6H2O������Ӧ���ʷֱ���v(NH3)��v(O2)��v(NO)��v(H2O) ��mol/(L��min)�ݱ�ʾ������ȷ�Ĺ�ϵʽ��( )A�� v(NH3)=v(O2) v(NH3)=v(O2) | B�� v(O2)=v(H2O) v(O2)=v(H2O) |
C�� v(NH3)=v(H2O) v(NH3)=v(H2O) | D�� v(O2)=v(NO) v(O2)=v(NO) |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com