
【题目】下列各组有机物中,只需加入溴水就能一一鉴别的是( )
A. 甲苯、苯、已烯B. 已炔、己烯、四氯化碳
C. 已烷、苯、乙醇D. 已烯、苯、苯酚
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】下图为元素周期表中前 4 周期的表格。
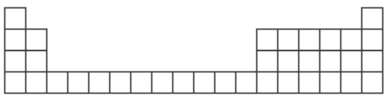
甲是一种常见化合物,其化学式为 XC13。
(1)根据你所学知识,将 X 代表的元素符号,填在所给周期表的表格中对应的位置__________(只写出2 种即可)
(2)若将一种XC13水溶液蒸干、灼烧,得到红棕色粉末 X2O3,则含碳的 X 合金在潮湿的(中性环境)空气中发生电化腐蚀时的正极反应式为__________。
(3)若 X代表另一种金属单质,该单质可与(2)中所述的粉末发生反应,该反应可用于_____。(写出一种用途);该元素的硫酸盐(约1 mol·L-1)和NaHCO3溶液(约1 mol·L-1)及起泡剂制成泡沫灭火剂。使用时发生的化学反应方程式是_______________________________,二者的体积比约是________。泡沫灭火器内的玻璃筒里盛 X 元素的硫酸盐溶液,为什么不能把它盛放在铁筒里________(用离子方程式解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
实验步骤 | 实验现象 |
①将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 | A. 有气体产生,溶液变成浅红色 |
②向新制得的Na2S溶液中滴加新制的氯水 | B. 生成淡黄色沉淀 |
③将一小块金属钠放入滴有酚酞溶液的冷水中 | C. 浮在水面上,熔成小球,做不定向移动,随之消失,溶液变成红色 |
④将镁条投入稀盐酸中 | D. 剧烈反应,迅速产生大量无色气体 |
⑤将铝条投入稀盐酸中 | E. 反应不十分剧烈,产生无色气体 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:认识同周期元素性质的递变规律
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液等。
仪器:试管,滴管,酒精灯,试管夹,镊子,小刀,玻璃片,砂纸等。
(3)实验内容:(填写与实验步骤对应的实验现象的标号和化学方程式)
实验内容 | 化学方程式 |
____________________ | |
____________________ | |
____________________ | |
____________________ | |
____________________ |
(4)实验结论:__________________________________________________
(5)请用原子结构的知识简单解释上述结论:__________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
向盛有硫酸铜水溶液的试管里加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解病得到深蓝色的透明液体;若向试管中加入一定量乙醇,析出深蓝色晶体。结合有关知识,回答下列问题:
(1)Cu、N、O、S元素第一电离能由大到小的顺序是_______(填元素符号);蓝色沉淀溶解时发生反应的离子方程式是________________。
(2)请解释加入乙醇后析出晶体的原因______________。
(3)SO42-的空间构型是_____________,其中S原子的杂化轨道类型是___________。
(4)NH3、H2O分子中,键角的大小顺序为_______(用分子式表示);NH3极易溶于H2O的原因,除了两种分子都是极性分子外,还因为_______________。
(5)Cu和O能形成一种化合物,其晶胞结构如图所示,则R所表示微粒的价电子排布式为_____;若相邻的两不同微粒间的距离为a cm,设阿伏伽德罗常数的数值为NA,则该晶体的密度为_______(用含a、NA的代数式表示)g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示:[已知:2SO2(g)+O2(g) ![]() 2SO3(g);△H=-196.9kJ/mol]
2SO3(g);△H=-196.9kJ/mol]

请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:_______________________;△H2=_______________;
(2)恒温恒容时,1molSO2和2molO2充分反应,放出热量的数值比|△H2|______(填 “大”、“小”或“相等”).
(3)恒容条件下,下列措施中能使n(SO3)/n(SO2)增大的有______。
a.升高温度 b.充入He气 c.再充入1molSO2(g)和1molO2(g) d.使用催化剂
(4)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是______;图中表示平衡混合物中SO3的含量最高的一段时间是______。
(5)含硫废弃的脱硫减排是减少大气中含硫化合物污染的关键,工业脱除废气中SO2的原理如下:

①用纯碱溶液吸收SO2,将其转化为HSO3-,该反应的离子方程式为___________________________;
②若石灰乳过量,将其产物再导入吸收池,其中可用于吸收SO2的物质的电子式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气和氨气是重要的工业原料,二者在常温下混合即可发生反应。某兴趣小组同学拟用如下装置设计实验来探究纯净、干燥的氯气与氨气的反应。回答下列问题:

(1)气体的制备与净化
① 氯气的发生装置可以选择上图中的_____,反应的化学方程式为_________。
② 干燥氨气选用上图中的______。氯气的净化装置的连接顺序为b![]() __________(按气流顺序,用小写字母表示)。
__________(按气流顺序,用小写字母表示)。
(2)氨气与氯气的反应
①上图中的装置连接顺序为A![]() _____
_____![]()
![]()
![]() B (用大写字母表示)。
B (用大写字母表示)。
氨气的入口是____(填“e”或“f”),原因是_______。另一生成物是空气的主要成分之一,试写出该反应的化学方程式:__________,写出一种此反应的工业用途:____________。
② 设计一个实验方案鉴定该固体是氯化铵(要求写出操作、现象及结论): __________。
若从装置D的G处逸出的尾气中含有少量Cl2,为防止其污染环境,可将尾气通过盛有__________的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,能在溶液中大量共存的是( )
A. Na+、Mg2+、Cl﹣、SO42﹣ B. Na+、Ca2+、CO32﹣、NO3﹣
C. Na+、H+、Cl﹣、CO32﹣ D. K+、Al3+、SO42﹣、OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体氧化物燃料电池(SOFC)以固体氧化物(能传导O2-)作为电解质,其工作原理如图所示。下列关于固体燃料电池的有关说法正确的是( )

A. 电极b为电池负极,电极反应式为O2+4e-=2O2-
B. 固体氧化物的作用是让电子在电池内通过
C. 若H2作为燃料气,接触面上发生的反应为:H2+2OH-—4e-=2H++H2O
D. 若C2H4作为燃料气,接触面上发生的反应为:C2H4+6O2-—12e-=2CO2+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com