
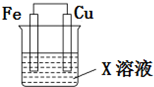
 选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转(指针偏转程度大),则其可能的组合共有( )
选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转(指针偏转程度大),则其可能的组合共有( )| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
分析 该装置是原电池,根据原电池的构成条件选择电极和电解质溶液,有相对活泼的金属和不活泼的金属或导电的非金属作电极,且较活泼的金属能自发的和电解质溶液进行氧化还原反应,据此分析解答.
解答 解:该装置是原电池,根据原电池的构成条件选取电极和电解质溶液.
当电解质溶液为稀硫酸时,只有铁能作负极,则正极可以是铜,也可以是铂,所以有两种组合;
当电解质溶液为硫酸铁时,负极可以是铁,则正极可以是铜,也可以是铂;若负极为铜时,正极只能是铂,所以有三种组合;
所以通过以上分析知,能构成原电池的组合有5种,
故选:B.
点评 本题以原电池的设计方法为载体考查了原电池原理,难度不大,根据原电池原理来选取电极材料和电解质溶液来分析解答即可.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO作氧化剂,具有氧化性 | |
| B. | HCl是还原产物 | |
| C. | 反应中H2O提供了氧原子,因此H2O是氧化剂 | |
| D. | 生成22.4 L CO2(标准状况)时,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 消耗铜的物质的量相等 | B. | 消耗硝酸的物质的量相等 | ||
| C. | 消耗铜的物质的量是①>②>③ | D. | 消耗硝酸的物质的量是①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
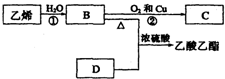 已知乙烯能发生以下转化:
已知乙烯能发生以下转化:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图是一次性电池--铜锌电池的简易装置.
如图是一次性电池--铜锌电池的简易装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用潮汐发电,将化学能转化为电能 | |
| B. | 不需富集,直接提取海水中的溴 | |
| C. | 用海水中的NaCl制取烧碱和纯碱 | |
| D. | 只需使海水中的碘升华就能得到碘单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com