
 如图是一次性电池--铜锌电池的简易装置.
如图是一次性电池--铜锌电池的简易装置.分析 铜片和锌片用导线连接后插入稀硫酸中形成了原电池,由于金属活动性Zn>Cu,Zn为负极,Cu为正极,电池工作时,负极上发生氧化反应,反应式为Zn-2e-=Zn2+,正极上发生还原反应,反应式为2H++2e-=H2↑;锂是一种活泼金属,锂离子电池必须用非水电解质,由此分析解答.
解答 解:(1)该电池的负极材料是锌,在外电路中,电流方向是正极铜流向负极锌,故答案为:锌;由铜到锌;
(2)正极上发生还原反应,正极反应式是2H++2e-=H2↑,故答案为:还原反应,2H++2e-=H2↑;
(3)锂是一种活泼金属,易与水反应,锂离子电池必须用非水电解质,故答案为:锂是活泼金属,易与水发生反应.
点评 本题考查原电池的基础知识,题目较为简单,注意原电池的组成和工作原理.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:选择题
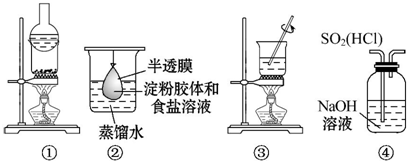
| A. | 用①分离氯化铵和单质碘 | |
| B. | 用②除去淀粉溶液中的氯化钠 | |
| C. | 用③加热胆矾(CuSO4•5H2O)制取无水硫酸铜 | |
| D. | 用④装置除去SO2中的HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯苯环上的一个氢原子被含4个碳原子的烷基取代,所得产物有12种 | |
| B. | 苯乙烯(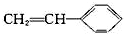 )和氢气完全加成的产物的一溴取代物有5种 )和氢气完全加成的产物的一溴取代物有5种 | |
| C. | 已知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目为3种 | |
| D. | 相对分子质量为106.5的一氯代烃,有8种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
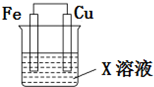 选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转(指针偏转程度大),则其可能的组合共有( )
选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转(指针偏转程度大),则其可能的组合共有( )| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,并指明A2C2分子中化学键的类型共价键(或极性共价键和非极性共价键).
,并指明A2C2分子中化学键的类型共价键(或极性共价键和非极性共价键).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若0.5molCH4全部和Cl2发生取代反应,生成物质的量相等的四种有机物,则消耗Cl2的物质的量是1.25mol | |
| B. | 将CH3OH和分子式为C3H8O的醇混合,发生分子间脱水反应,可以得到的醚有6种 | |
| C. | 工业上要生产氯乙烷,用CH3CH3与Cl2发生取代反应制取比用CH2═CH2与HCl发生加成反应制取好 | |
| D. | 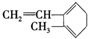 与Br2发生1:1加成反应,其加成产物最多有5种 与Br2发生1:1加成反应,其加成产物最多有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气与氯气反应生成2mol氯化氢气体,需要释放183kJ的热量 | |
| B. | 氢气与氯气反应生成2mol氯化氢气体,需要吸收183kJ的热量 | |
| C. | 氢气与氯气反应生成1mol氯化氢气体,需要吸收183kJ的热量 | |
| D. | 氢气与氯气反应生成1mol氯化氢气体,需要释放183kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com