
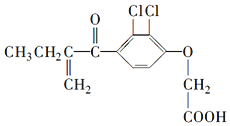
| A. | 利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4 | |
| B. | 利尿酸分子内处于同一平面的原子不超过10个 | |
| C. | 1mol利尿酸能与7mol H2发生加成反应 | |
| D. | 利尿酸能与FeCl3溶液发生显色反应 |
分析 A.利用结构简式可确定分子式;
B.苯环、C=C、C=O为平面结构,与苯环直接相连的原子一定在同一平面内;
C.苯环、C=C、C=O能发生加成;
D.不含苯酚结构.
解答 解:A.由结构简式可确定分子式为C13H12Cl2O4,与甲醇反应生成的酯为C14H14Cl2O4,故A正确;
B.苯环、C=C、C=O为平面结构,与苯环直接相连的原子一定在同一平面内,所以利尿酸分子内处于同一平面的原子为17个,故B错误;
C.苯环、C=C、C=O能发生加成,1 mol利尿酸能与5mol H2发生加成反应,故C错误;
D.不含苯酚结构,则利尿酸不能与FeCl3溶液发生显色反应,故D错误;
故选A.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握有机物的结构和官能团的性质,为解答该类题目的关键,难度不大.


科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:选择题
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为
S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=xkJ•mol-1
已知:碳的燃烧热△H1=akJ•mol-1
S(s)+2K(s)═K2S(s)△H2=bkJ•mol-1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=ckJ•mol-1则x为
A.3a+b-c B.c-3a-b C.a+b-c D.c-a-b
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
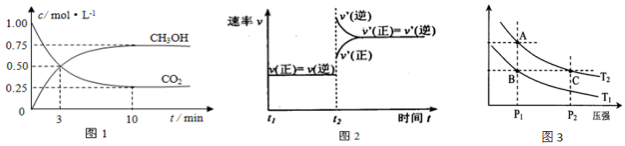
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 40% | C. | 60% | D. | 70% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是含有碳元素的化合物都是有机化合物 | |
| B. | 所有的有机化合物均难溶解于水 | |
| C. | 有机物组成元素较少,而有机物的种类繁多 | |
| D. | 完全燃烧只生成CO2和H2O的有机物是烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
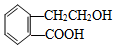 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.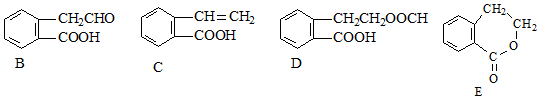
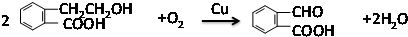 ,反应类型:氧化反应
,反应类型:氧化反应 ,反应类型:酯化反应
,反应类型:酯化反应 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com