
【题目】利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式:
SO2(g)+NH3H2O(aq)=NH4HSO3(aq) △H1=a kJmol﹣1
NH3H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) △H2=b kJmol﹣1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) △H3=c kJmol﹣1
(1)反应2SO2(g)+4NH3H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=____kJmol﹣1。
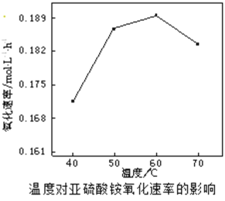
(2)空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是________。
(3)以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用.反应的离子方程式为CaSO4(s)+CO32﹣(aq)SO42﹣(aq)+CaCO3(s),该反应的平衡常数K=________.[已知Ksp(CaCO3)=2.9×10﹣9,Ksp(CaSO4)=9.1×10﹣6]
【答案】2a+2b+c 温度过高(NH4)2SO3会分解(或水解),浓度减小(或温度升高氧气在溶液中溶解度降低) 3138
【解析】
(1)根据盖斯定律进行计算;
(2)根据图1分析,60℃氧化速率最快;温度过高(NH4)2SO3会分解(或水解),或溶液中的氧气的量减小;
(3)反应的离子方程式为CaSO4(s)+CO32-(aq)![]() SO42-(aq)+CaCO3(s),该反应的平衡常数
SO42-(aq)+CaCO3(s),该反应的平衡常数![]() ,带入数值进行计算。
,带入数值进行计算。
(1)①根据盖斯定律,给已知方程式编号
①SO2(g)+NH3·H2O(aq)═NH4HSO3(aq) △H1=akJ·mol-1;
②NH3·H2O(aq)+NH4HSO3(aq)═(NH4)2SO3(aq)+H2O(l) △H2=bkJ·mol-1;
③2(NH4)2SO3(aq)+O2(g)═2(NH4)2SO4(aq) △H3=ckJ·mol-1;
反应①×2+②×2+③,可得2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l),则△H=△H1×2+△H2×2+△H3= (2a+2b+c)kJ·mol-1;
(2)根据图1分析,60℃氧化速率最快,则在空气氧化(NH4)2SO3的适宜温度为60℃,温度过高(NH4)2SO3会分解(或水解),浓度减小;或温度升高氧气在溶液中溶解度降低,造成氧化速率减慢;答案为:温度过高(NH4)2SO3会分解(或水解),浓度减小(或温度升高氧气在溶液中溶解度降低);
(3)反应的离子方程式为CaSO4(s)+CO32-(aq)![]() SO42-(aq)+CaCO3(s),该反应的平衡常数
SO42-(aq)+CaCO3(s),该反应的平衡常数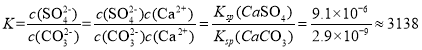 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)往2L密闭容器中充入1molN2和3molH2,在一定条件下发生合成氨反应,2min时达到平衡。测得平衡混合气体中NH3的体积分数为25%,则:
①0~2min内,v(NH3)=_________。
②H2在平衡混合气中的体积分数=_________。
③平衡时容器的压强与起始时的压强之比为_________。
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
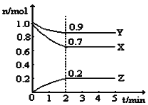
①该反应的化学方程式为_____________。
②2min反应达平衡容器内混合气体的平均相对分子质量比起始时____________(填“大”,“小”或“相等”下同),混合气体密度比起始时____________。
③上述反应在第2min时,X的转化率为_________
④将amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=n(Z),则原混合气体中a:b=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校科学兴趣小组探究二氧化碳与过氧化钠反应是否有氧气生成,设计了如图的实验装置.B中盛有饱和碳酸氢钠溶液,目的是除去二氧化碳中混有的氯化氢气体,E为收集氧气装置.

(1)写出装置A中发生反应的化学方程式____________。
(2)C中盛有____________,目的是_____________。
(3)写出装置D中发生反应的化学方程式__________。
(4)指出装置E的错误_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示。下列说法正确是

A. 有MnO2条件下的反应曲线是a曲线
B. a曲线变为b曲线,反应的活化分子百分数增大
C. a曲线变为b曲线,平衡时H2O2的转化率增大
D. b曲线的热化学方程式为:H2O2(l) =H2O(l) +1/2O2(g) ΔH= - ( E1 - E2)KJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 27g铝箔在酒精灯上充分加热反应转移电子总数是3NA
B. 2.0gCO2与SO2的混合气体分子中,含有的质子数为NA
C. 25℃时,Ksp(BaSO4)=1×1010,则BaSO4饱和溶液中Ba2+数目为1×105NA
D. 7.8gNa2O2中含有的阴、阳离子的总数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A.某温度下,1 L pH = 6 的纯水中含 OH一为10-8mol
B.25℃ 时,向0. 1 mo lL-1 CH3COONa 溶液中加入少量水,溶液中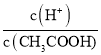 减小
减小
C.25℃时,将 V1 L pH = 11的 NaOH溶液与V2 L pH = 3 的H A 溶液混合,溶液显中性,则V1 ≤V2
D.25℃时,将 a molL-1 氨水与0.01 molL- 1 盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),用含a的代数式表示 NH3H2O)的电离常数 Kb = ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生验证浓硫酸性质的实验如图。下列叙述错误的是

A.反应一段时间后,b处滤纸条褪色
B.蘸有NaOH溶液的棉花团作用是吸收多余的SO2,防止污染空气
C.化学反应方程式:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
D.硫酸型酸雨形成的可能原因是:SO2+H2O![]() H2SO3;O2+2H2SO3=2H2SO4
H2SO3;O2+2H2SO3=2H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是 ( )
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 与![]() 互为同分异构体的芳香族化合物有6种
互为同分异构体的芳香族化合物有6种
C. 含有5个碳原子的某饱和链烃,其一氯取代物可能有3种
D. 菲的结构简式为![]() ,它与硝酸反应,可生成 5种一硝基取代物
,它与硝酸反应,可生成 5种一硝基取代物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com