
【题目】某学生验证浓硫酸性质的实验如图。下列叙述错误的是

A.反应一段时间后,b处滤纸条褪色
B.蘸有NaOH溶液的棉花团作用是吸收多余的SO2,防止污染空气
C.化学反应方程式:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
D.硫酸型酸雨形成的可能原因是:SO2+H2O![]() H2SO3;O2+2H2SO3=2H2SO4
H2SO3;O2+2H2SO3=2H2SO4
【答案】C
【解析】
A.Cu与浓硫酸混合加热发生反应:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,产生的SO2气体具有漂白性,能够使b处蘸有品红溶液的试纸褪色,A正确;
CuSO4+SO2↑+2H2O,产生的SO2气体具有漂白性,能够使b处蘸有品红溶液的试纸褪色,A正确;
B.NaOH是碱,能够与酸性氧化物SO2反应产生盐,因此蘸有NaOH溶液的棉花团可以吸收多余的SO2,防止污染空气,B正确;
C.Cu与浓硫酸反应需在加热条件下进行,若不加热,不具备反应条件,反应不能发生,C错误;
D.硫酸型酸雨形成的原因是:SO2与空气中的水反应产生H2SO3,H2SO3具有强的还原性,与O2反应产生H2SO4,反应方程式为:SO2+H2O![]() H2SO3;2H2SO3+O2=2H2SO4,D正确;
H2SO3;2H2SO3+O2=2H2SO4,D正确;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】“笔、墨、纸、砚”在中国传统文化中被称为“文房四宝”,下列说法中错误的是( )
A | B | C | D |
|
|
|
|
用灼烧法可鉴别羊毫与尼龙毫的真伪 | 墨的主要成分是碳单质 | 纸的主要成分属于合成材料 | 用石材制作砚台的过程是物理变化 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种重要的结构陶瓷材料,可用作LED的基质材料,通过等离子法由SiH4(沸点-111.9℃)与氨气反应制取的方程式如下:3SiH4+4NH3=Si3N4+12H2。设NA是阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,1.8gSiH4所含质子的数目为3.2NA
B.标准状况下,4.48LNH3和H2的混合气体所含分子总数为0.2NA
C.NA个NH3分子溶于1L的水,所得溶液的物质的量浓度为1mol·L-1
D.当生成1molSi3N4时,转移电子数目为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式:
SO2(g)+NH3H2O(aq)=NH4HSO3(aq) △H1=a kJmol﹣1
NH3H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) △H2=b kJmol﹣1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) △H3=c kJmol﹣1
(1)反应2SO2(g)+4NH3H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=____kJmol﹣1。
(2)空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是________。
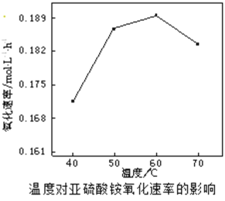
(3)以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用.反应的离子方程式为CaSO4(s)+CO32﹣(aq)SO42﹣(aq)+CaCO3(s),该反应的平衡常数K=________.[已知Ksp(CaCO3)=2.9×10﹣9,Ksp(CaSO4)=9.1×10﹣6]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前中国已经通过自主创新成功研发出第一台锌溴液流储能系统,实现了锌溴电池的隔膜、极板、电解液等关键材料自主生产。锌溴电池的原理装置图如图所示,下列说法错误的是( )

A.充电时电极石墨棒A连接电源的正极
B.放电过程中阴离子通过隔膜从正极区移向负极区
C.放电时负极反应为2Br-—2e-=Br2
D.放电时右侧电解质储罐中的离子总浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了验证碳和硅两种元素非金属性的相对强弱,用图示装置进行实验(夹持仪器已略去,气密性已检验)。

回答下列问题:
(1)仪器a的名称:___________________。
(2)打开弹簧夹1,关闭弹簧夹2,旋开仪器a的活塞滴加盐酸。一段时间后,A中现象是________;原因是________。
(3)关闭弹簧夹1,打开弹簧夹2,D中出现白色胶状沉淀,X是________(填化学式),D中发生反应的化学方程式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组成员为研究金属铜与强酸的反应 ,将6.4g铜粉分为两等份,进行了如下实验,请完成有关计算。
(1)取其中一份铜粉投入200mL氢离子浓度为 1molL-1 硫酸和硝酸混合液中,微热使反应充分完成后,生成一氧化氮气体448mL(标准状况)。则反应前混合溶液中硫酸的物质的量浓度为_________(写出计算过程)。
(2)用NaOH溶液吸收氮氧化物是防止NO2污染的一种方法。原理为2NO2 + 2NaOH=NaNO3 + NaNO2 + H2O,NO + NO2 + 2NaOH=2NaNO2 + H2O。取另一份铜粉溶于过量的硝酸溶液,假设硝酸的还原产物只有一氧化氮和二氧化氮,生成的混合气体能被amol NaOH溶液完全吸收,试讨论a的取值范围:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下列实验现象,得出的结论正确的是
操作 | 实验现象 | 结论 | |
A | 向NaBr 溶液中加入过量氯水,再加入淀粉 KI 溶液 | 最终溶液变蓝 | 氧化性:Cl2>Br2>I2 |
B | 向某无色溶液中滴加浓盐酸 | 产生能使品红溶液褪色的气体 | 不能证明原溶液中含有SO32-或HSO3- |
C | 向蔗糖溶液中加入稀硫酸,水浴加热后, 加入新制氢氧化铜,加热 | 得到蓝色溶液 | 蔗糖水解产物没有还原性 |
D | 向2mL 0.01mol/L的AgNO3溶液中滴加几滴同浓度的NaCl溶液后,滴加 KI 溶液 | 先产生白色沉淀,后出现黄色沉淀 | 证明Ksp(AgI)<Ksp(AgCl) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种具有强氧化性的黄绿色气体,也是优良的消毒剂,熔点-59℃、沸点11℃,易溶于水,易与碱液反应。ClO2浓度大时易分解爆炸,在生产和使用时必须用稀有气体或空气等进行稀释,实验室常用下列方法制备:2NaC1O3+Na2SO3+H2SO4![]() 2C1O2↑+2Na2SO4+H2O。
2C1O2↑+2Na2SO4+H2O。
(1)H2C2O4可代替Na2SO3制备ClO2,该反应的化学方程式为___,该方法中最突出的优点是___。
(2)ClO2浓度过高时易发生分解,故常将其制备成NaClO2固体,以便运输和贮存。
已知:2NaOH+H2O2+2ClO2=2NaClO2+O2+2H2O,实验室模拟制备NaC1O2的装置如图所示(加热和夹持装置略)。
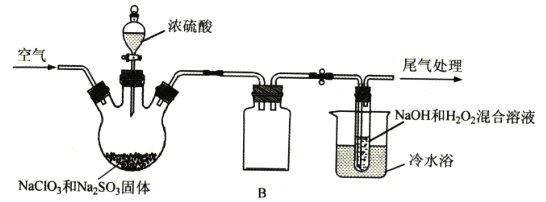
①产生ClO2的温度需要控制在50℃,应采取的加热方式是___;盛放浓硫酸的仪器为:___;NaC1O2的名称是___;
②仪器B的作用是___;冷水浴冷却的目的有___(任写两条);
③空气流速过快或过慢,均会降低NaC1O2的产率,试解释其原因___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com