
【题目】ClO2是一种具有强氧化性的黄绿色气体,也是优良的消毒剂,熔点-59℃、沸点11℃,易溶于水,易与碱液反应。ClO2浓度大时易分解爆炸,在生产和使用时必须用稀有气体或空气等进行稀释,实验室常用下列方法制备:2NaC1O3+Na2SO3+H2SO4![]() 2C1O2↑+2Na2SO4+H2O。
2C1O2↑+2Na2SO4+H2O。
(1)H2C2O4可代替Na2SO3制备ClO2,该反应的化学方程式为___,该方法中最突出的优点是___。
(2)ClO2浓度过高时易发生分解,故常将其制备成NaClO2固体,以便运输和贮存。
已知:2NaOH+H2O2+2ClO2=2NaClO2+O2+2H2O,实验室模拟制备NaC1O2的装置如图所示(加热和夹持装置略)。
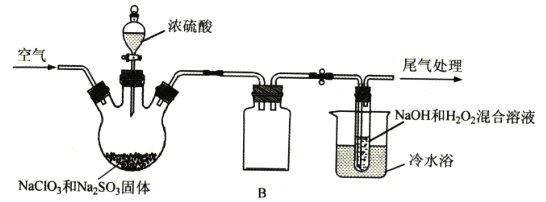
①产生ClO2的温度需要控制在50℃,应采取的加热方式是___;盛放浓硫酸的仪器为:___;NaC1O2的名称是___;
②仪器B的作用是___;冷水浴冷却的目的有___(任写两条);
③空气流速过快或过慢,均会降低NaC1O2的产率,试解释其原因___。
【答案】2NaClO3+H2C2O4+H2SO4=2ClO2↑+Na2SO4+H2O+2CO2↑ 反应中产生的CO2可以起到稀释ClO2的作用,避免ClO2浓度大时分解爆炸,提高了安全性 水浴加热 分液漏斗 亚氯酸钠 安全瓶,防倒吸 降低NaClO2的溶解度,增大ClO2的溶解度,减少H2O2分解,减少ClO2分解 空气流速过快时,ClO2不能被充分吸收:空气流速过慢时,ClO2浓度过高导致分解
【解析】
![]() 中的氯是+4价的,因此我们需要一种还原剂将氯酸钠中+5价的氯还原,同时要小心题干中提到的易爆炸性。再来看实验装置,首先三颈烧瓶中通入空气,一方面可以将产物“吹”入后续装置,另一方面可以起到稀释
中的氯是+4价的,因此我们需要一种还原剂将氯酸钠中+5价的氯还原,同时要小心题干中提到的易爆炸性。再来看实验装置,首先三颈烧瓶中通入空气,一方面可以将产物“吹”入后续装置,另一方面可以起到稀释![]() 的作用,防止其浓度过高发生危险,B起到一个安全瓶的作用,而C是吸收装置,将
的作用,防止其浓度过高发生危险,B起到一个安全瓶的作用,而C是吸收装置,将![]() 转化为
转化为![]() ,据此来分析本题即可。
,据此来分析本题即可。
(1)用草酸来代替![]() ,草酸中的碳平均为+3价,因此被氧化产生+4价的二氧化碳,方程式为2NaClO3+H2C2O4+H2SO4=2ClO2↑+Na2SO4+H2O+2CO2↑;产生的
,草酸中的碳平均为+3价,因此被氧化产生+4价的二氧化碳,方程式为2NaClO3+H2C2O4+H2SO4=2ClO2↑+Na2SO4+H2O+2CO2↑;产生的![]() 可以稀释
可以稀释![]() ,防止其浓度过高发生危险;
,防止其浓度过高发生危险;
(2)①50℃最好的加热方式自然是水浴加热,盛放浓硫酸的仪器为分液漏斗,![]() 中的氯元素为+3价,因此为亚氯酸钠;
中的氯元素为+3价,因此为亚氯酸钠;
②仪器B是一个安全瓶,防止倒吸;而冰水浴一方面可以减少![]() 的分解,另一方面可以使
的分解,另一方面可以使![]() 变为液体,增大产率;
变为液体,增大产率;
③当空气流速过快时,![]() 来不及被充分吸收,当空气流速过慢时,
来不及被充分吸收,当空气流速过慢时,![]() 又会在容器内滞留,浓度过高导致分解。
又会在容器内滞留,浓度过高导致分解。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】某学生验证浓硫酸性质的实验如图。下列叙述错误的是

A.反应一段时间后,b处滤纸条褪色
B.蘸有NaOH溶液的棉花团作用是吸收多余的SO2,防止污染空气
C.化学反应方程式:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
D.硫酸型酸雨形成的可能原因是:SO2+H2O![]() H2SO3;O2+2H2SO3=2H2SO4
H2SO3;O2+2H2SO3=2H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“太阳水”电池装置如图所示,该电池由三个电极组成,其中 a 为TiO2电极,b 为Pt 电极,c 为 WO3 电极,电解质溶液为 pH=3 的 Li2SO4-H2SO4 溶液。锂离子交换膜将电池分为 A、B 两个区,A 区与大气相通,B 区为封闭体系并有 N2 保护。下列关于该电池的说法错误的是
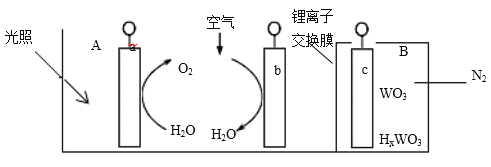
A.若用导线连接a、c,则 a 为负极,该电极附近 pH 减小
B.若用导线连接 a、c,则 c 电极的电极反应式为HxWO3-xe-=WO3+ xH+
C.若用导线连接 b、c,b 电极的电极反应式为 O2+4H++4e-=2H2O
D.利用该装置,可实现太阳能向电能转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是 ( )
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 与![]() 互为同分异构体的芳香族化合物有6种
互为同分异构体的芳香族化合物有6种
C. 含有5个碳原子的某饱和链烃,其一氯取代物可能有3种
D. 菲的结构简式为![]() ,它与硝酸反应,可生成 5种一硝基取代物
,它与硝酸反应,可生成 5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸分子的结构式可表示为 ,下列叙述正确的是:
,下列叙述正确的是:
(1)乙酸的电离,是①键断裂
(2)乙酸与乙醇发生酯化反应,是②键断裂
(3)在红磷存在时,Br2与乙酸发生反应CH3COOH+Br2![]() CH2BrCOOH+HBr是③键断裂
CH2BrCOOH+HBr是③键断裂
A.(1)(2)B.(1)(2)(3)C.(2) (3)D.(1)(3)、
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个1L 的密闭容器中,X、Y、Z 三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:
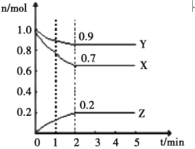
(1)2min时,Y 的物质的量浓度是____________;
(2)从开始至2min,X 的平均反应速率为_________;
(3)该反应的化学方程式为____________________;
(4)1min时,v(正)____v(逆),2min时,v(正)____v(逆) (填“>”或“<”或“=”);
(5)在2min时,向容器中通入氩气,增大体系压强,X 的化学反应速率将______;
(6)2min时,x的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的性质与原子结构、元素在周期表中的位置有着密切的关系。回答下列问题:
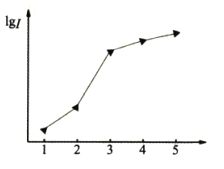
(1)如图表示某短周期元素X的前五级电离能(I)的对数值,试推测并写出X的元素符号___。
(2)化合物甲与SO2所含元素种类相同,两者互为等电子体,请写出甲的化学式___,甲分子中心原子的杂化类型是___。
(3)配位化学创始人维尔纳发现,将1mo1CoC13·5NH3(紫红色)和1mo1CoC134NH3(绿色)溶于水,加入AgNO3溶液,立即沉淀的AgCl分别为2mo1、1mol。则紫红色配合物中配离子的化学式为___,绿色配合物中Co的配位数为___。
(4)某稀土元素M的氧化物晶体为立方晶胞,其结构如图所示,图中小球代表氧离子,大球代表M离子。
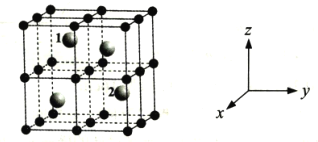
①写出该氧化物的化学式___。
②己知该晶体密度为ρg·cm-3,晶胞参数为anm,NA为阿伏加德罗常数的值。则M的相对原子质量Mr=___(用含ρ、a等的代数式表示);
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1(M原子)的坐标为(![]() ,
,![]() ,
,![]() ),则原子2(M原子)的坐标为___。
),则原子2(M原子)的坐标为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
B. H2O是极性分子,分子中O原子处在2个H原子所连成的直线的中央
C. CO2是非极性分子,分子中C原子处在2个O原子所连成的直线的中央
D. NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钯是航天、航空高科技领域的重要材料。工业用粗钯制备高纯度钯的流程如图:
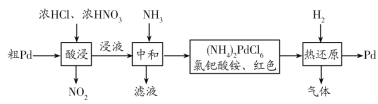
下列说法错误的是( )
A.酸浸时反应的化学方程式是Pd+6HC1+4HNO3=H2PdCl6+4NO2↑+4H2O
B.“热还原”中每生成1molPd同时生成的气体的物质的量为8mol
C.化学实验中可利用氯钯酸根离子检验溶液中是否含有NH4+
D.在“酸浸”过程中为加快反应速率可用浓硫酸代替浓盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com