
| A. | 物质燃烧不一定是放热反应 | |
| B. | 放热反应一定不需要从外界吸收任何能量就能发生 | |
| C. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| D. | 在一个确定的化学反应中,反应物总能量总是高于生成物总能量 |
分析 A.物质的燃烧反应都是放热反应;
B.某些物质的燃烧,需要吸收能量,达到着火点;
C.化学反应中除了遵循质量守恒定律,还遵循能量守恒定律;
D.根据△H=生成物的能量和-反应物的能量和来判断.
解答 解:A.所有物质的燃烧反应都是放热反应,故A错误;
B.某些物质的燃烧,需要从外界吸收能量,达到着火点,故B错误;
C.化学反应中除了遵循质量守恒定律,还遵循能量守恒定律,故C正确;
D.根据△H=生成物的能量和-反应物的能量和,在确定的化学反应中,反应物的总能量可能高于生成物的总能量,也可能低于生成物的总能量,故D错误;
故选C.
点评 本题考查了反应热的判断与以及反应的吸放热和反应条件之间的关系,题目难度不大,注意知识的归纳和梳理是关键.


科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z三种元素可形成化合物X3YZ4 | |
| B. | X、Y两元素形成的化合物只能为离子化合物 | |
| C. | 氢化物的熔沸点:Y<Z | |
| D. | 氢化物的稳定性:Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
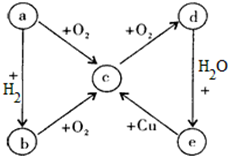
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实 验 步 骤 | 解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: (1)A的相对分子质量为90. |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重 5.4g和13.2g. | (2)A的分子式为C3H6O3. |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (3)用结构简式表示A中含有的官能团 -COOH、-OH |
(4)A的核磁共振氢谱如下图: | (4)A中含有4种氢原子. 综上所述, A的结构简式为  . . |
| (5)两分子A可反应生成一个六元环状化合物 | (5)写出此反应的方程式 2  $→_{△}^{浓硫酸}$ $→_{△}^{浓硫酸}$ +2H2O +2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中X为还原产物 | |
| B. | X能使溴水褪色,说明X具有漂白性 | |
| C. | 该反应中每生成1molFe2O3转移电子数约为6.02×1023 | |
| D. | 该反应生成的气体通入足量Ba(NO3)2溶液中,可得到两种沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4、3、5 | B. | 4、3、6 | C. | 2、5、4 | D. | 4、4、6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
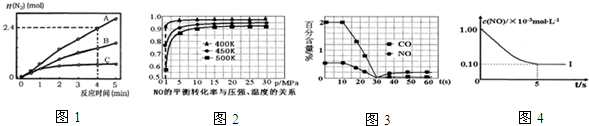
| 实验编号 | T(K) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表面积(m2/g) |
| Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
| Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
| Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com