
【题目】I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是________腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式:_______________
II.在如图用石墨作电极的电解池中,放入500mL饱和NaCl溶液并滴入酚酞,进行电解,观察到B电极附近溶液先变红。请回答下列问题:

(1)A接的是电源的_______极,B是该装置______。
(2)写出电解时总反应的离子方程式:____________________________ 。
(3)电解后溶液的pH______ ;(填 增大、减小或不变)要使电解后溶液恢复到电解前的状态,则需加入_______ 。
(4)若电源为碱性锌锰干电池,负极为______ 正极为______ 电解质溶液是_______
【答案】吸氧 O2+4e-+2H2O=4OH- 正极 阴极 写出电解时总反应的离子方程式:2Cl- + 2H2O ====(电解)H2↑+Cl2↑+2OH- 增大 HCl 气体 锌 二氧化锰 氢氧化钾溶液
【解析】
I.(1)钢铁腐蚀主要是电化学腐蚀,其中又以吸氧腐蚀为主;
(2)氧气在正极得到电子,电极反应式为O2+4e-+2H2O=4OH-;
II.(1)由电解池的结构进行判断;
(2)电解饱和食盐水的离子方程式为:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;
(3)电解后生成了OH-,所以溶液的pH值增大,电解过程中逸出了氢气和氯气,要使电解后溶液恢复到电解前的状态,则需加入HCl气体;
(4)碱性锌锰干电池中Zn为负极,MnO2为正极,电解质溶液是氢氧化钾溶液。
I.(1)炒过菜的铁锅因腐蚀而出现红褐色锈斑,铁锅中电解质溶液一般为弱酸性或者中性,溶解空气中一定量的氧气,发生吸氧腐蚀,故答案为:吸氧。
(2)铁锅发生吸氧腐蚀时,氧气在正极得到电子,发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-。
II.(1)根据题意“B电极附近溶液先变红”,说明B电极生成了NaOH,则B为阴极,A为阳极,与电源正极相连的是电解池的阳极,故答案为:正极,阴极。
(2)根据分析可知,氯化钠和水都被电解,所以总的反应式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
(3)电解后生成了OH-,所以溶液的pH值增大,电解过程中逸出了氢气和氯气,要使电解后溶液恢复到电解前的状态,则需加入HCl气体,故答案为:增大,HCl气体。
(4)碱性锌锰干电池总反应方程式为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,由反应方程式可知,Zn为负极,MnO2为正极,电解质溶液是氢氧化钾溶液,故答案为:锌,二氧化锰,氢氧化钾溶液。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3+Cl2![]() PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.40mol B. 0.20mol
C. 小于0.20mol D. 大于0.20mol,小于0.40mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高磷鲕状赤铁矿(主要含有![]() 、少量
、少量![]() 、CaO,
、CaO,![]() 等)是我国一种重要的沉积型铁矿资源,以高磷鲕状赤铁矿为原料制备纯度较高的铁红,其流程如图所示。下列说法错误的是
等)是我国一种重要的沉积型铁矿资源,以高磷鲕状赤铁矿为原料制备纯度较高的铁红,其流程如图所示。下列说法错误的是
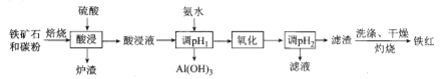
A. 铁红可用于油漆、油墨、建筑物着色剂
B. 酸浸液遇![]() 溶液生成蓝色沉淀
溶液生成蓝色沉淀
C. 洗涤滤渣时要用玻璃棒不断搅拌
D. 氧化时选用的试剂可以是![]() 、NaClO溶液
、NaClO溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在常温下测得浓度均为0.1molL﹣1的下列四种溶液的pH如下表:
溶质 | NaHCO3 | Na2CO3 | NaF | NaClO |
pH | 8.4 | 11.6 | 7.5 | 9.7 |
(1)用离子方程式表示NaClO溶液的pH = 9.7的原因___________________________。
(2)根据盐溶液的pH,可知①Ka(HClO) ②Ka1(H2CO3) ③Ka(HF) ④Ka2(H2CO3)的由大到小顺序为_________________________________ (填序号)。
(3)将少量CO2通入NaClO溶液中,写出该反应的离子方程式:________________。
(4)常温下,将CO2通入0.1molL﹣1的Na2CO3溶液中至中性,则溶液中2c(CO32-)+ c(HCO3-)=_________________(列计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是用于治疗帕金森病的药物,名称为匹莫范色林,一种合成路线如图所示:
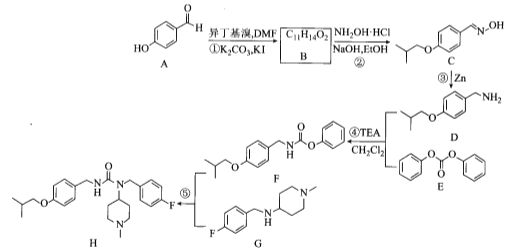
请回答下列问题:
(1)A的化学名称为_____________。
(2)B的结构简式为____________。
(3)D中官能团的名称是__________。
(4)③、⑤的反应类型分别为________、________。
(5)反应④的化学方程式为______________。
(6)芳香化合物X是E的同分异构体,X中含有两个苯环,能与FeCl3溶液发生显色反应也能发生银镜反应,其核磁共振氢谱显示有6种不同化学环境的氢,符合条件的X有:___种,写出其中一种的结构简式:________。
(7)已知: 。参考上述合成路线和信息,设计以化合物A和溴乙烷,乙醇为原料(无机试剂任选).制备
。参考上述合成路线和信息,设计以化合物A和溴乙烷,乙醇为原料(无机试剂任选).制备 的合成路线:______。
的合成路线:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]俗称摩尔盐.硫酸亚铁在空气中易被氧化,但与硫酸铵反应生成摩尔盐后较稳定.模拟工业制备硫酸亚铁铵晶体的实验装置如图所示.回答下列问题:

(1)先用饱和碳酸钠溶液煮沸铁屑(含少量油污、铁锈等),再用清水洗净.用饱和碳酸钠溶液煮沸的目的是________________.仪器a的名称是______________.
(2)按如图连接好装置,经检验气密性良好后加入相应的药品,打开K1、K2,关闭K3,装置B中发生反应的离子方程式可能_______________(填字母序号).
A.Fe+2H+=Fe2++H2↑ B.2Fe+6H+=2Fe3++3H2↑
C. Fe2 03+6H+=2Fe3+ +3H2O D. 2Fe3++Fe=3Fe2+
铁屑快反应完时,打开____________,关闭____________,装置B中的溶液会流入装置A,其原因是_____________________.
(3)常温下,将反应后的溶液放置一段时间,瓶底将结晶析出硫酸亚铁铵.为了测定晶体中Fe2+的含量,称取一份质量为4.0g的硫酸亚铁铵晶体样品,配成溶液.用0.1mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液体积为20.00mL.反应到达滴定终点的现象为_________________,计算晶体中Fe2+的质量分数为_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4L己烷中含有分子数目为NA
B. 1mol/LNaOH溶液中含有Na+数目为NA
C. 7.8gNa2O2中含有的共价键数目为0.1NA
D. 将0.5molN2O4充入密闭容器中充分反应转化成NO2的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨在工业生产中具有重要意义。
(1)在合成氨工业中I2O5常用于定量测定CO的含量。己知2I2(s)+5O2(g)=2I2O5(s) △H=-76kJ·mol-1;2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1。则该测定反应的热化学方程式为____________________________________。
(2)不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数φ (CO2)随时间t变化曲线如图。

①b点CO的平衡转化率α为____________,c点的平衡常数K为________________。
②下列措施能提高该反应CO转化率的是________(填字母)
a.升高温度 b.增大压强 c.加入催化剂 d.移走CO2
(3)若氨水与SO2恰好生成正盐,则此时溶液呈_________(填“酸性”或“碱性”),向上述溶液中通入___________(填“NH3”或“SO2”)可使溶液呈中性。(已知常温下NH3·H2O的Kb=1.8×10-5mol·L-1,H2SO3的Ka1=1.5×10-2mol·L-1,Ka2=6.3×10-8mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是

A. 根据图①可判断该可逆反应正反应为吸热反应
B. 若②表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,则乙对应的压强大
3C(g)+D(s)的影响,则乙对应的压强大
C. 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D. 根据图④,若除去CuSO4溶被中的Fe3+,可向溶液中加入适量CuO,调节pH至4左右
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com