
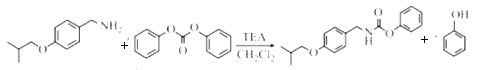
【题目】化合物H是用于治疗帕金森病的药物,名称为匹莫范色林,一种合成路线如图所示:
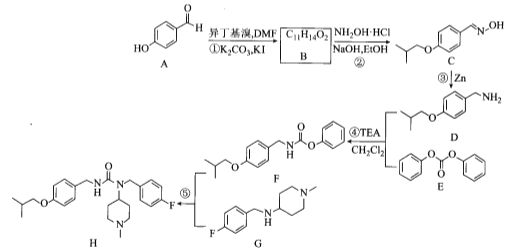
请回答下列问题:
(1)A的化学名称为_____________。
(2)B的结构简式为____________。
(3)D中官能团的名称是__________。
(4)③、⑤的反应类型分别为________、________。
(5)反应④的化学方程式为______________。
(6)芳香化合物X是E的同分异构体,X中含有两个苯环,能与FeCl3溶液发生显色反应也能发生银镜反应,其核磁共振氢谱显示有6种不同化学环境的氢,符合条件的X有:___种,写出其中一种的结构简式:________。
(7)已知: 。参考上述合成路线和信息,设计以化合物A和溴乙烷,乙醇为原料(无机试剂任选).制备
。参考上述合成路线和信息,设计以化合物A和溴乙烷,乙醇为原料(无机试剂任选).制备 的合成路线:______。
的合成路线:______。
【答案】4-羟基苯甲醛(或对羟基苯甲醛) 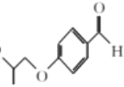 醚键、氨基 还原反应 取代反应
醚键、氨基 还原反应 取代反应 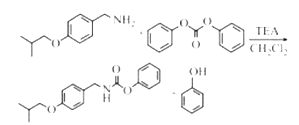 6
6 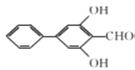 或
或 (其他合理答案也可以给分)
(其他合理答案也可以给分) 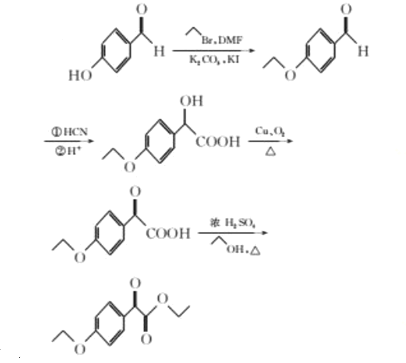
【解析】
有机物A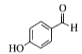 通过与卤代烃在一定条件下生成了醚
通过与卤代烃在一定条件下生成了醚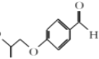 ,再与
,再与![]() 反应生成C物质
反应生成C物质 ,该物质在Zn的作用下发生还原反应可以得到D物质
,该物质在Zn的作用下发生还原反应可以得到D物质![]() ,D物质
,D物质![]() 与E物质
与E物质![]() 通过取代反应生成F
通过取代反应生成F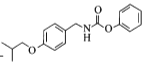 ,F物质
,F物质 与G物质
与G物质 通过再一次取代反应生成目标产物H
通过再一次取代反应生成目标产物H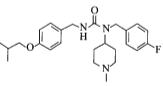 ,以此推断解题。
,以此推断解题。
(1).从A物质的结构简式 可看出该物质含有酚羟基和醛基,可将醛基和苯环作为母链,将羟基进行编号,可命名为4-羟基苯甲醛或根据习惯命名法将该物质命名为对羟基苯甲醛,故答案为4-羟基苯甲醛(或对羟基苯甲醛);
可看出该物质含有酚羟基和醛基,可将醛基和苯环作为母链,将羟基进行编号,可命名为4-羟基苯甲醛或根据习惯命名法将该物质命名为对羟基苯甲醛,故答案为4-羟基苯甲醛(或对羟基苯甲醛);
(2).通过对比A物质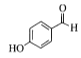 与C物质
与C物质 结构上的变化,可发现第一步和第二步反应主要改变的是苯环上所连的支链
结构上的变化,可发现第一步和第二步反应主要改变的是苯环上所连的支链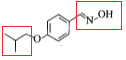 。结合B的分子式,可知由A到B的反应中增加了三个碳原子,由此可推断出B物质的结构简式为
。结合B的分子式,可知由A到B的反应中增加了三个碳原子,由此可推断出B物质的结构简式为 ,故答案为
,故答案为  ;
;
(3). 从该物质的结构简式![]() 可看出该物质含有两种官能团
可看出该物质含有两种官能团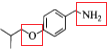 分别为醚键(C-O-C)、氨基(-NH/span>2),故答案为醚键、氨基;
分别为醚键(C-O-C)、氨基(-NH/span>2),故答案为醚键、氨基;
(4). 反应③中C物质的结构 变为D物质的结构
变为D物质的结构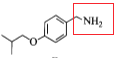 ,在该反应中氧原子个数减少,氢原子个数增加,该反应类型为还原反应;反应⑤中产物H是由F物质的红框部分
,在该反应中氧原子个数减少,氢原子个数增加,该反应类型为还原反应;反应⑤中产物H是由F物质的红框部分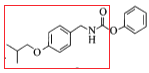 与G物质的红框部分
与G物质的红框部分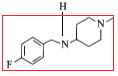 所构成的,结合该反应“代换”的特点,可判断出该反应类型为取代反应,故答案为还原反应、取代反应。
所构成的,结合该反应“代换”的特点,可判断出该反应类型为取代反应,故答案为还原反应、取代反应。
(5).从反应④的主要目标产物结构式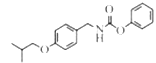 ,可看出分别是由两种反应物
,可看出分别是由两种反应物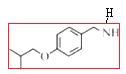 与
与 红框部分合成目标产物,同时剩下的部分组合成苯酚,故该反应的方程式为:
红框部分合成目标产物,同时剩下的部分组合成苯酚,故该反应的方程式为:
 ;
;
(6). 芳香化合物X是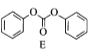 的同分异构体,X中含有两个苯环,能与FeCl3溶液发生显色反应,说明含有酚羟基;能发生银镜反应,说明含有醛基,不能确定结构的只有一个氧原子。又因其核磁共振氢谱显示有6种不同化学环境的氢,说明其同分异构体具有很强的对称性,故符合条件的X结构简式为
的同分异构体,X中含有两个苯环,能与FeCl3溶液发生显色反应,说明含有酚羟基;能发生银镜反应,说明含有醛基,不能确定结构的只有一个氧原子。又因其核磁共振氢谱显示有6种不同化学环境的氢,说明其同分异构体具有很强的对称性,故符合条件的X结构简式为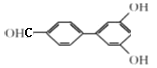 、
、 、
、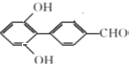 、
、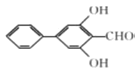 、
、![]() 、
、![]() 共6种,可写出其中任一种的结构简式。故答案为6 、
共6种,可写出其中任一种的结构简式。故答案为6 、 或
或![]() ;
;
(7). 以化合物 和溴乙烷,乙醇为原料制备
和溴乙烷,乙醇为原料制备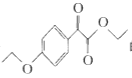 时,可观察出可利用反应①的方法合成醚键结构,再利用与HCN发生加成反应增长含有醛基一侧的支链,通过催化氧化将醇羟基氧化为羰基,最后再与乙醇发生酯化反应来合成最终产物。具体合成路线为:
时,可观察出可利用反应①的方法合成醚键结构,再利用与HCN发生加成反应增长含有醛基一侧的支链,通过催化氧化将醇羟基氧化为羰基,最后再与乙醇发生酯化反应来合成最终产物。具体合成路线为:
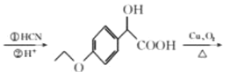
 。
。


科目:高中化学 来源: 题型:
【题目】一定温度下,对可逆反应A(g)+2B(g)![]() 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A. C生成的速率与C分解的速率相等
B. 单位时间内消耗amolA,同时生成3amolC
C. 容器内的压强不再变化
D. 混合气体的物质的量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)AsH3的电子式为___。
(2)改变0.1mol·L-1三元弱酸H3AsO4溶液的pH,溶液中的H3AsO4、H2AsO4-、HAsO42-及AsO43-的物质的量分布分数随pH的变化如图所示:

①lgKa1(H3AsO4)=_____。
②用甲基橙作指示剂,用NaOH溶液滴定H3AsO4发生的主要反应的离子方程式为___。
(3)焦炭真空冶炼砷时需加入催化剂,其中部分热化学反应如下:
反应Ⅰ.As2O3(g)+3C(s)![]() 2As(g)+3CO(g) △H1=akJ·mol-1
2As(g)+3CO(g) △H1=akJ·mol-1
反应Ⅱ.As2O3(g)+3C(s)![]()
![]() As4(g)+3CO(g) △H2=bkJ·mol-1
As4(g)+3CO(g) △H2=bkJ·mol-1
反应Ⅲ.As4(g)![]() 4As(g) △H
4As(g) △H
①△H=____kJ·mol-1(用含a、b的代数式表示)。
②反应中催化剂的活性会因为发生反应Ⅱ(生成As4)而降低,同时存在的反应Ⅲ使As4量减少。相关数据如下表:
反应Ⅱ | 反应Ⅲ | ||
活化能(kJ·mol-1) | 催化剂X | 56 | 75 |
催化剂Y | 37 | 97 | |
由上表判断催化剂X____(填“优于”或“劣于”)Y,理由是_____。
(4)反应2As2S3(s)![]() 4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:

①对应温度下,B点的反应速率v(正)_____v(逆)(填“>”“<”或“=”)。
②A点处,AsS(g)的分压为____kPa,该反应的Kp=_____kPa5(Kp为以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组的同学为测定某Na2CO3和NaCl的固体混合物样品中Na2CO3的质量分数进行了以下实验。请你参与并完成对有关问题的解答:

(1)甲同学用图1所示装置测定CO2的质量。实验时稀硫酸是与样品中的__________(填“Na2CO3”或“NaCl”)发生反应,仪器b的名称是__________,洗气瓶c中盛装的是浓硫酸,此浓硫酸的作用是____________________。
(2)乙同学用图2所示装置,取一定质量的样品m g和足量稀硫酸反应进行实验,完成样品中Na2CO3质量分数的测定。
①实验前,检查该装置气密性的方法是先打开活塞a,由b注入水至其下端玻璃管中形成一段水柱,再将针筒活塞向内推压,若b下端玻璃管中的___________________,则装置气密性良好。
②在实验完成时,能直接测得的数据是CO2的______(填“体积”或“质量”)。
(3)丙同学用下图所示方法和步骤进行实验:

①操作Ⅰ涉及的实验名称有:__________、洗涤;操作Ⅱ涉及的实验名称有干燥、__________。
②丙同学测得样品中Na2CO3的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室测定水体中氯离子含量,实验过程如下:向水样中加入K2CrO4溶液作指示剂,用0.0010 mol·L-1AgNO3溶液滴定至终点。已知:Ag2CrO4为不溶于水的砖红色沉淀;常温下Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)= 1.8×10-12。回答下列问题:
(1)滴定时,应使用____________(填“酸式”或“碱式”) 滴定管。
(2)滴定达到终点的标志是___________________________________________。
(3)实验过程中测得数据如下表:
编号 | 1 | 2 | 3 |
V(水样)/mL | 10.00 | 10.00 | 10.00 |
V(AgNO3)/mL | 3.75 | 4.01 | 3.99 |
计算水样中氯离子的含量为_______________mg/L(保留2位小数)
(4)滴定结束后:
①当溶液中的残余c(Cl-)=1.8×10-5mol/L,则此时溶液中c(CrO42-)=____________ mol·L-1。
②已知2AgCl+ CrO42-![]() 2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________。
2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________。
(5)下列情况会造成实验测定结果偏低的是____________。(填标号)
A.锥形瓶洗涤后未干燥 B.滴定前,未使用标准液润洗滴定管
C.滴定管滴定前仰视读数,滴定后俯视读数
D.滴定管滴定前尖嘴部分充满溶液,滴定结束时滴定管尖嘴有气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是________腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式:_______________
II.在如图用石墨作电极的电解池中,放入500mL饱和NaCl溶液并滴入酚酞,进行电解,观察到B电极附近溶液先变红。请回答下列问题:

(1)A接的是电源的_______极,B是该装置______。
(2)写出电解时总反应的离子方程式:____________________________ 。
(3)电解后溶液的pH______ ;(填 增大、减小或不变)要使电解后溶液恢复到电解前的状态,则需加入_______ 。
(4)若电源为碱性锌锰干电池,负极为______ 正极为______ 电解质溶液是_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义.
(1)海水中无机碳的存在形式及分布如下图所示:
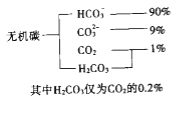
用离子方程式表示海水呈弱碱性的原因______________.已知春季海水pH=8.1,预测夏季海水碱性将会_____________(填写“增强”或“减弱”),理由是_________________________.
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)CH3OH(g) △H<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇.如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.下列说法正确的是_______________.
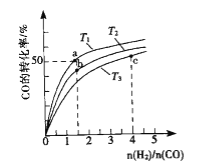
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点状态下再通入0.5 mol co和0.5 mol CH3OH,平衡不移动
D.c点状态下再通入1 mol co和4mol H2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:
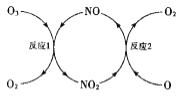
①NO的作用是___________________。
②已知:O3(g)+0(g)=202(g) △H=-143kJ·mol-l
反应1: O3(g)+NO(g)NO2(g)+O2(g) △H1=-200.2kJ·mol-l
反应2:热化学方程式为_____________________。
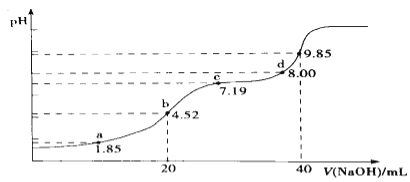
(4)大气污染物SO2可用NaOH吸收.已知pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。该温度下用0.1mol· L-1 NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液的滴定曲线如图所示.b点所得溶液中各离子浓度由大到小的顺序是________________;c点所得溶液中:c(Na+)___________3c(HSO3-)(填“>”、“<”或“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将金属钠置于空气中加热,可以观察到有淡黄色固体生成,试写出该反应的方程式:__________________________________。
(2)在实验室模拟侯氏制碱法制备碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气(NH3)达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体和氯化铵溶液。该过程的总的化学方程式为:____________________________________________。
(3)加热NaHCO3得到纯碱制品,实验室进行此操作的装置可以是_____________(填选项)。

(4)某实验小组通过下列实验探究过氧化钠与水的反应:

加入MnO2后,反应的化学方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是病人输液用的葡萄糖(分子式为C6H12O6)注射液的标签上的部分内容。据标签所提供的信息,以下说法错误的是( )
5%葡萄糖注射液
500 mL
(性状)本品为无色或几乎为无色的透明液体
(规格)500 mL 25 g
(贮藏)密封保存
A. 该注射液中葡萄糖的质量分数是5%
B. 葡萄糖的摩尔质量为180 g·mol-1
C. 该注射液的密度约为1g·cm-3
D. 该注射液中葡萄糖的物质的量浓度约为0.014mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com