
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2013届湖南省高二上学期期中考试化学(理)试卷 题型:填空题
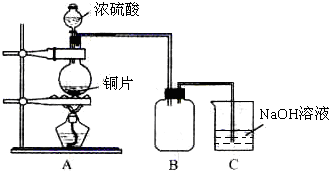
 当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是
。
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是
。
⑷在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是 。
28. (9分)下列一句话中叙述了两个值,前者记为M,后者记为N,M和N的关系从A、B、C、D中选择
A. M>N B. M<N C. M=N D. 无法比较
⑴相同温度下,1L 1mol/L 的NH4Cl溶液中的NH4+个数和2 L 0.5mol·L-1NH4Cl溶液中NH4+的个数: ;
⑵相同温度下,pH值为12的烧碱溶液中水的电离度和pH值为12的CH3COONa溶液中水的电离度: ;
⑶两份室温时的饱和石灰水,一份升温到50℃;另一份加入少量CaO,恢复至室温,两溶液中的c(Ca2+): ;
⑷常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中c(HCO3-): ;
⑸将pH值为2的醋酸和盐酸都稀释相同倍数所得稀溶液的pH值: ;
⑹常温下0.1mol/L的CH3COOH与0.1mol/LCH3COONa等体积混合后溶液中c(Na+)和c(CH3COO-): ;
⑺同温度下,0.1mol/LFeCl3溶液中Fe3+水解百分率与0.01mol·L-1FeCl3溶液中Fe3+ 的水解百分率: ;
⑻室温下某强酸和某强碱溶液等体积混合后,溶液的pH值为7,原酸溶液和原碱溶液的物质的量浓度: ;
⑼PH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的M倍和N倍,稀释后两溶液的PH值仍然相同, 则M和N的关系是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
⑷在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是 。
28. (9分)下列一句话中叙述了两个值,前者记为M,后者记为N,M和N的关系从A、B、C、D中选择
A. M>N B.M<N C.M=N D. 无法比较
⑴相同温度下,1L 1mol/L 的NH4Cl溶液中的NH4+个数和2 L 0.5mol·L-1NH4Cl溶液中NH4+的个数: ;
⑵相同温度下,pH值为12的烧碱溶液中水的电离度和pH值为12的CH3COONa溶液中水的电离度: ;
⑶两份室温时的饱和石灰水,一份升温到50℃;另一份加入少量CaO,恢复至室温,两溶液中的c(Ca2+): ;
⑷常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中c(HCO3-): ;
⑸将pH值为2的醋酸和盐酸都稀释相同倍数所得稀溶液的pH值: ;
⑹常温下0.1mol/L的CH3COOH与0.1mol/LCH3COONa等体积混合后溶液中c(Na+)和c(CH3COO-): ;
⑺同温度下,0.1mol/LFeCl3溶液中Fe3+水解百分率与0.01mol·L-1FeCl3溶液中Fe3+ 的水解百分率: ;
⑻室温下某强酸和某强碱溶液等体积混合后,溶液的pH值为7,原酸溶液和原碱溶液的物质的量浓度: ;
⑼PH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的M倍和N倍,稀释后两溶液的PH值仍然相同, 则M和N的关系是: 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖南省衡阳八中高二上学期期中考试化学(理)试卷 题型:填空题
 当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
⑷在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是 。
28.(9分)下列一句话中叙述了两个值,前者记为M,后者记为N,M和N的关系从A、B、C、D中选择
A. M>N B. M<N C. M="N" D. 无法比较
⑴相同温度下,1L 1mol/L 的NH4Cl溶液中的NH4+个数和2 L 0.5mol·L-1NH4Cl溶液中NH4+的个数: ;
⑵相同温度下,pH值为12的烧碱溶液中水的电离度和pH值为12的CH3COONa溶液中水的电离度: ;
⑶两份室温时的饱和石灰水,一份升温到50℃;另一份加入少量CaO,恢复至室温,两溶液中的c(Ca2+): ;
⑷常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中c(HCO3-): ;
⑸将pH值为2的醋酸和盐酸都稀释相同倍数所得稀溶液的pH值: ;
⑹常温下0.1mol/L的CH3COOH与0.1mol/LCH3COONa等体积混合后溶液中c(Na+)和c(CH3COO-): ;
⑺同 温度下,0.1mol/LFeCl3溶液中Fe3+水解百分率与0.01mol·L-1FeCl3溶液中Fe3+的水解百分率: ;
温度下,0.1mol/LFeCl3溶液中Fe3+水解百分率与0.01mol·L-1FeCl3溶液中Fe3+的水解百分率: ;
⑻室温下某强酸和某强碱溶液等体积混合后,溶液的pH值为7, 原酸溶液和原碱溶液的物质的量浓度: ;
原酸溶液和原碱溶液的物质的量浓度: ;
⑼PH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的M倍和N倍,稀释后两溶液的PH值仍然相同,则M和N的关系是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com