
【题目】(1)下面是4种粒子的结构示意图:
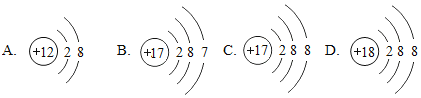
图中粒子共能表示_______种元素,图中表示的阳离子是____________(用离子符号表示),图中A所表示的元素在元素周期表中的位置_____________________________.
(2)在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:

①写出D单质的电子式_____________________;
②写出C的最高价氧化物的结构式_____________________;
③E和F分别形成的气态氢化物中较稳定的是(填写氢化物的化学式)_____________________;
④A最高价氧化物的水化物所含化学键为___________________,其晶体类型为________,其水溶液与B反应的离子方程式为___________________________;
(3)X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示.下列说法正确的是 (______)
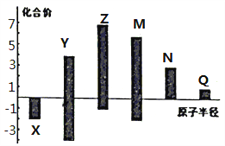
A.金属性:N>Q B.最高价氧化物对应水化物酸性:M>Y>N
C.简单离子半径:Q>N>X D.原子序数:Z>M>X>Y
【答案】 3 Mg2+ 第三周期第IIA族 ![]() O=C=O HCl 离子键 和 共价键 离子晶体 2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑ BD
O=C=O HCl 离子键 和 共价键 离子晶体 2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑ BD
【解析】(1)质子数相同,为同种元素,故上图中表示四种元素;阳离子中质子数大于核外电子数所以B是阳离子,是镁离子,离子符号为:Mg2+;A和E质子数相同都为17,都是氯元素,氯元素位于元素周期表的第三周期。
(2)根据元素在周期表中的分布,可知A是Na,B是Al,C是C,D是N,E是S,F是Cl。
①D单质(N2)的电子式为![]() ;②C的最高价氧化物(CO2)的结构式为O=C=O;③同周期元素的原子从左到右,氢化物的稳定性逐渐增强,所以E和F分别形成的气态氢化物(H2S和HCl)中较稳定的是(填写氢化物的化学式):HCl;④A最高价氧化物的水化物(NaOH)所含化学键为离子键和共价键;其晶体类型为离子晶体,其水溶液与B(Al)反应的离子方程式为2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑。
;②C的最高价氧化物(CO2)的结构式为O=C=O;③同周期元素的原子从左到右,氢化物的稳定性逐渐增强,所以E和F分别形成的气态氢化物(H2S和HCl)中较稳定的是(填写氢化物的化学式):HCl;④A最高价氧化物的水化物(NaOH)所含化学键为离子键和共价键;其晶体类型为离子晶体,其水溶液与B(Al)反应的离子方程式为2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑。
(3)由图知X化合价为-2价,没有正价,故X为O元素;M的化合价为+6价、-2价,故M为S元素;Z的最高正价为+7价、最低为-1价,故Z为Cl元素;Y的化合价为+4价、-4价,原子半径小于Cl,故Y为C元素;N为+3价,原子半径大于S,故N为Al元素;Q为+1价,处于IA族,原子半径大于Al,故Q为Na元素。A项,同周期从左向右金属性减弱,故金属性Na>Al,A错误;B项,非金属性越强,最高价氧化物对应的水化物的酸性越强,故H2SO4>H2CO3>HAlO2,B正确;C项,电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+>Al3+,C错误;D项,原子序数Z(Cl)>M(S)>X(O)>Y(C),D正确。故选BD。


科目:高中化学 来源: 题型:
【题目】已知下列九种物质:①H2O,②Al,③CO2,④盐酸,⑤硫酸钡,⑥NaOH⑦饱和FeCl3溶液,⑧氨水,⑨乙醇。根据上述提供的物质,回答下列问题:
(1)属于电解质的是 _______________________(填序号),属于非电解质__________(填序号)。
(2)上述物质间发生的某反应的离子方程式为H++OH===H2O,则该反应的化学方程式为_________________________________________________________________________。
(3)实验室制备少量Fe(OH)3胶体所用的物质有__________(填序号),反应的离子方程式为____________________________________________________________________________。
(4)Al和Na的单质同时加入到一定量的水中,充分反应后,发现既无沉淀生成又无固体残留物存在,请用两个离子方程式表示其变化:______________________________; ____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烯烃与苯在一定条件下反应生成芳香烃,如: ![]() +H2C=CH2
+H2C=CH2 ![]()
![]()
![]() +2H2C=CH2
+2H2C=CH2 ![]()
![]() +2H2C=CH2
+2H2C=CH2 ![]()
![]()
丙烯是三大合成材料的基本原料,可用于合成应用广泛的DAP树脂单体和双酚等有机物,具有重要的工业用途.
(1)写出丙烯在一定条件下发生聚合反应的化学方程式 .
(2)丙烯与苯在一定条件下反应可生成M、N等多种芳香烃.红外光谱、核磁共振是研究机物结构的重要方法,根据下列数据,写出M,N的结构简式. M:元素组成:C89.99%、H 10.06%;1H核磁共振有5个信号.
N:元素组成:C88.82%、H11.18%;1H核磁共振有3个信号.
M: , N: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为测定Na2CO3固体(含少量NaCl)的纯度,设计如图装置(含试剂)进行实验. 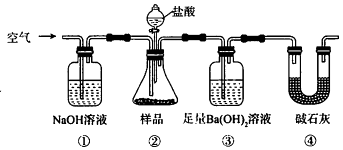
下列说法不正确的是( )
A.必须在②③间添加吸收HCl的装置
B.④的作用是防止空气中的气体影响实验的精确度
C.通入空气的作用是保证②中产生的气体完全转移到③中
D.称取样品和③中产生的沉淀的质量即可求算Na2CO3固体的纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质作用时,反应条件(温度、反应物用量)改变,不会引起产物种类改变的是( )
A.Na和O2B.Fe和O2
C.Fe和HClD.C和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、实验室可以用KMnO4固体和浓盐酸反应制取少量Cl2,反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O回答下列问题:
(1)该反应中被氧化的元素是__________.
(2)氧化性:KMnO4__________Cl2(填“>”、“<”或“=”)
(3)该反应中氧化剂和氧化产物的物质的量之比为__________.
(4)用双线桥法表示该反应中电子转移的方向和数目:_________
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
(5)每生成标准状况下2.24L Cl2,反应中转移电子的物质的量为__________.
Ⅱ、实验室常用以下方法制取氯气:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O请你根据所学知识回答下列问题:
MnCl2+Cl2↑+2H2O请你根据所学知识回答下列问题:
(1)把氯气通入紫色石蕊试液中,可以观察到的现象是:________________,请你解释其中的原因 __________________________________________________
(2)为保证实验安全,常用NaOH溶液吸收多余的氯气。写出反应的化学方程式__________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡. I、已知H2A在水中存在以下平衡:H2AH++HA﹣ , HA﹣H++A2﹣ .
(1)NaHA溶液的pH(填大于、小于或等于) Na2A溶液的pH.
(2)某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性.此时该混合溶液中下列关系中,一定正确的是 . a.c(H+)c(OH﹣)=1×10﹣14 b.c(Na+)+c(K+)=c(HA﹣)+2c(A2﹣)
c.c(Na+)>c(K+) d.c(Na+)+c(K+)=0.05mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2﹣(aq)△H>0. ①降低温度时,Ksp(填“增大”、“减小”或“不变”).
②滴加少量浓盐酸,c(Ca2+)(填“增大”、“减小”或“不变”).
(4)II、含有Cr2O72﹣的废水毒性较大,某工厂废水中含5.00×10﹣3 molL﹣1的Cr2O72﹣ . 为使废水能达标排放,作如下处理: Cr2O72﹣ ![]() Cr3+、Fe3+
Cr3+、Fe3+ ![]() Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
①该废水中加入绿矾(FeSO47H2O)和H+ , 发生反应的离子方程式为: .
②欲使10L该废水中的Cr2O72﹣完全转化为Cr3+ , 理论上需要加入g FeSO47H2O.
③若处理后的废水中残留的c(Fe3+)=2×10﹣13molL﹣1 , 则残留的Cr3+的浓度为 . (已知:Ksp[Fe(OH)3]=4.0×10﹣38 Ksp[Cr(OH)3]=6.0×10﹣31)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通玻璃的主要成分是:( ) ①Na2SiO3②CaCO3③CaSiO3④SiO2⑤Na2CO3⑥CaO.
A.①③⑥
B.②③④
C.①③④
D.③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com