
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡. I、已知H2A在水中存在以下平衡:H2AH++HA﹣ , HA﹣H++A2﹣ .
(1)NaHA溶液的pH(填大于、小于或等于) Na2A溶液的pH.
(2)某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性.此时该混合溶液中下列关系中,一定正确的是 . a.c(H+)c(OH﹣)=1×10﹣14 b.c(Na+)+c(K+)=c(HA﹣)+2c(A2﹣)
c.c(Na+)>c(K+) d.c(Na+)+c(K+)=0.05mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2﹣(aq)△H>0. ①降低温度时,Ksp(填“增大”、“减小”或“不变”).
②滴加少量浓盐酸,c(Ca2+)(填“增大”、“减小”或“不变”).
(4)II、含有Cr2O72﹣的废水毒性较大,某工厂废水中含5.00×10﹣3 molL﹣1的Cr2O72﹣ . 为使废水能达标排放,作如下处理: Cr2O72﹣ ![]() Cr3+、Fe3+
Cr3+、Fe3+ ![]() Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
①该废水中加入绿矾(FeSO47H2O)和H+ , 发生反应的离子方程式为: .
②欲使10L该废水中的Cr2O72﹣完全转化为Cr3+ , 理论上需要加入g FeSO47H2O.
③若处理后的废水中残留的c(Fe3+)=2×10﹣13molL﹣1 , 则残留的Cr3+的浓度为 . (已知:Ksp[Fe(OH)3]=4.0×10﹣38 Ksp[Cr(OH)3]=6.0×10﹣31)
【答案】
(1)小于
(2)BC
(3)减小;增大
(4)Cr2O72﹣+6Fe2++14H+=2Cr3++6Fe3++7H2O ;83.4;3×10﹣6mol?L﹣1
【解析】解:I(1)二元弱酸根离子第一步水解程度远远大于第二步水解程度,水解程度越大,钠盐溶液碱性越强,所以NaHA溶液的pH小于Na2A溶液的pH,所以答案是:小于;(2)a.水的离子积常数与温度有关,温度越高,水的离子积常数越大,温度未知,所以水的离子积常数未知,故a错误;
b.溶液呈电中性,溶液中阴阳离子所带电荷相等,溶液呈中性,氢离子浓度等于氢氧根离子浓度,所以c(Na+)+c(K+)=c(HA﹣)+2c(A2﹣),故b正确;
c.NaHA溶液呈碱性,向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的物质的量应大于氢氧化钾的物质的量,所以同一混合溶液中c(Na+)>c(K+),故c正确;
d.NaHA溶液呈碱性,向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的体积应大于氢氧化钾的体积,所以c(Na+)+c(K+)>0.05mol/L,故d错误;
故选:BC.(3)①降低温度,抑制难溶物的电离,所以导致溶度积常数变小.
所以答案是:减小;②加盐酸,促进难溶盐的电离,使平衡向正反应方向移动,所以钙离子浓度增大.
所以答案是:增大;II(1)酸性条件下,Cr2O72﹣具有强氧化性,亚铁离子具有还原性,二者发生氧化还原反应生成铬离子和铁离子,离子方程式为Cr2O72﹣+6Fe2++14H+=2Cr3++6Fe3++7H2O,所以答案是:Cr2O72﹣+6Fe2++14H+=2Cr3++6Fe3++7H2O;(2)某工厂废水中含5.00×10﹣3 molL﹣1的Cr2O72﹣,n(Cr2O72﹣)=10L×5.00×10﹣3mol/L=5.00×10﹣2mol;
依据氧化还原反应离子方程式:6Fe2++Cr2O72﹣+14H+=6Fe3++2Cr3++7H2O,得到n(Fe2+)=5.00×10﹣2mol×6=0.3mol;需要FeSO47H2O蒸馏=0.3mol×278g/mol=83.4g,所以答案是:83.4;②若处理后的废水中残留的c(Fe3+)=2×10﹣13molL﹣1,Ksp[Fe(OH)3]=c(Fe3+)c3(OH﹣)=4.0×10﹣38,计算得到c3(OH﹣)=2×10﹣25mol/L,则残留的Cr3+的浓度为Ksp[Cr(OH)3]=c(Cr3+)c3(OH﹣)=6.0×10﹣31 ,c(Cr3+)=3×10﹣6molL﹣1,
所以答案是:3×10﹣6molL﹣1.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】下列变化中,加入氧化剂才可以实现的是( )
A. Cl2→Cl- B. H+ → H2 C. Na2O → NaOH D. Cu → Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下面是4种粒子的结构示意图:
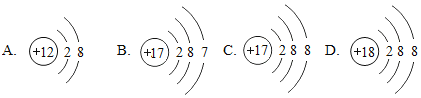
图中粒子共能表示_______种元素,图中表示的阳离子是____________(用离子符号表示),图中A所表示的元素在元素周期表中的位置_____________________________.
(2)在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:

①写出D单质的电子式_____________________;
②写出C的最高价氧化物的结构式_____________________;
③E和F分别形成的气态氢化物中较稳定的是(填写氢化物的化学式)_____________________;
④A最高价氧化物的水化物所含化学键为___________________,其晶体类型为________,其水溶液与B反应的离子方程式为___________________________;
(3)X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示.下列说法正确的是 (______)
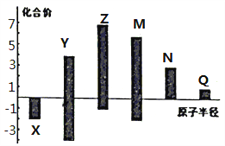
A.金属性:N>Q B.最高价氧化物对应水化物酸性:M>Y>N
C.简单离子半径:Q>N>X D.原子序数:Z>M>X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示中,A是一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应的火焰均呈黄色。
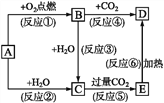
填写下列空白:
(1)写出化学式:A_____,B_____,D______________。
(2)以上反应中属于氧化还原反应的有_____(填序号)。
(3)写出反应⑤的离子方程式:___。写出反应⑥的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应m A(s)+n B(g)e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( ) 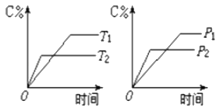
A.达平衡后,若升温,则K减小
B.达平衡后,加入催化剂C%增大
C.化学方程式中n>e+f
D.达平衡后,若增加A的量,B的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中的Cl-浓度与100 mL 1 mol·L-1 MgCl2溶液中的Cl-浓度相等的是( )
A. 150 mL 2mol·L-1 NaCl溶液 B. 50 mL 2 mol·L-1 CaCl2溶液
C. 150 mL 2 mol·L-1 KClO3溶液 D. 75 mL 1 mol·L-1 AlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. 氢氧化钠的摩尔质量是40 g
B. 1 mol硫酸的质量是98gmol﹣1
C. 甲烷的摩尔质量就是它的相对分子质量
D. 1 mol NH3含N原子数约是6.02×1023个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验过程如图所示,则图③试管中的现象是( )
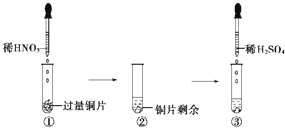
A.铜片溶解,产生无色气体,该气体遇空气变为红棕色
B.铜片溶解,产生无色气体,该气体遇到空气不变色
C.铜片溶解,放出红棕色有刺激性气味的气体
D.无明显现象,因稀硫酸不与铜反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com