
在一可压缩的密闭容器中,发生可逆反应:M(g)+N(?)![]() P(g)+Q(g) △H>0,当压缩体积时,M的转化率不变。在其它条件不变的情况下,采用以下措施使M的转化率增大( )
P(g)+Q(g) △H>0,当压缩体积时,M的转化率不变。在其它条件不变的情况下,采用以下措施使M的转化率增大( )
![]() A.加入一定量的M B.加入一定量的不与M、N、P、Q反应的气体
A.加入一定量的M B.加入一定量的不与M、N、P、Q反应的气体
![]() C.反应温度升高 D.加入某物质作催化剂
C.反应温度升高 D.加入某物质作催化剂
![]()
![]()
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol?L-1) | 0.40 | 0.6 | 0.6 |
| c(CH3OCH3)c(H2O) |
| c2(CH3OH) |
| c(CH3OCH3)c(H2O) |
| c2(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮化硅(Si3N4)是一种新型陶瓷材料,它可在高温下的氮气流中由石英与焦炭通过以下反应制得:
氮化硅(Si3N4)是一种新型陶瓷材料,它可在高温下的氮气流中由石英与焦炭通过以下反应制得:| c6(CO) |
| c2(N2) |
| c6(CO) |
| c2(N2) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
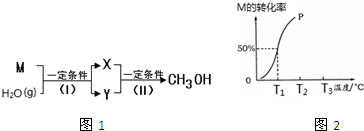
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com