
在一定温度下的定容容器中,发生反应:2A(g)+B(s) C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2:1:1
⑤单位时间内生成n molC,同时生成n mol D
⑥单位时间内生成n molD,同时生成2n mol A
A.①②⑤ B.①③⑥ C.②③⑥ D.②③④
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
类比乙烯和乙醇的化学性质,推测丙烯醇(CH2=CH-CH2OH)可发生的反应有( )
①加成反应 ②氧化反应 ③燃烧 ④与钠反应
⑤取代反应 ⑥与NaOH溶液反应
A.只有①②③⑥ B.只有①②③④ C.只有①③④⑥ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氢化亚铜(CuH)是一种难溶、易分解的物质,能与稀盐酸反应,Cu+在酸性条件下发生反应2Cu+===Cu2++Cu。下列有关说法不正确的是 ( )
A.CuH与稀盐酸反应的化学方程式为2CuH+2HCl===CuCl2+2H2↑+Cu
B.CuH在足量氯气中燃烧的化学方程式为2CuH+Cl2===2Cu+2HCl
C.CuH与稀硝酸反应的化学方程式为CuH+3HNO3===Cu(NO3)2+NO↑+2H2O
D.CuH受热分解的化学方程式为2CuH===2Cu+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是元素周期表的一部分,下列对相关元素的叙述正确的是( )。
A.X元素的原子有二个电子层,处于周期表的第14纵行
B.Z的原子序数为31,单质常温下为液体
C.气态氢化物水溶液的酸性X<Z<Y
D.X的气态氢化物与Y的最高价氧化物的水化物能反应生成盐
查看答案和解析>>
科目:高中化学 来源: 题型:
水热法制备Fe3O4纳米颗粒的总反应为:
 。下列说法正确的是( )。
。下列说法正确的是( )。
A.Fe2+、S2O32-都是还原剂 B.每生成1 mol Fe3O4,则转移电子数为3 mol
C.硫元素被氧化,铁元素被还原 D. x=2
查看答案和解析>>
科目:高中化学 来源: 题型:
某种燃料电池的工作原理示意如图所示,a、b均为惰性电极。
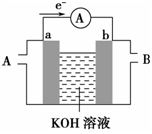
(1)a电极是电池的__________极(填“正”或“负”),空气从_________口通入(填“A”或“B”);
(2)假设使用的“燃料”是氢气(H2),a极的电极反应式是____________________________。
(3)假设使用的“燃料”是甲醇(CH3OH),a极的电极反应式是_________________________。如果该电池工作时电路中通过1.2mol电子,则消耗CH3OH有__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应既是氧化还原反应,又是吸热反应的是( )。
A.铝片与稀H2SO4的反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2的反应 D.甲烷在O2中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学为探究元素周期表中元素性质的递变规律,利用右图装置验证同主族元素非金属性的变化规律。
某同学为探究元素周期表中元素性质的递变规律,利用右图装置验证同主族元素非金属性的变化规律。
(1)仪器B的名称为____________,干燥管D的作用为防止____________。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C溶液中现象为_______________ ________________,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________________溶液吸收尾气。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加________________(写化学式)溶液,若观察到 C中出现白色沉淀,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装
C中出现白色沉淀,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装 有________________溶液的洗气瓶。
有________________溶液的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,0.1 mol/L某一元酸(HA)溶液中 =1×10-8,下列叙述正确的是( )
=1×10-8,下列叙述正确的是( )
A.溶液中水电离出的c(H+)=10-10 mol/L B.溶液中c(H+)+c(A-)=0.1 mol/L
C.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
D.与0.05mol/L NaOH溶液等体积混合后所得溶液中离子浓度大小关系为
c(A-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com