
【题目】如图所示,甲和乙均是双液原电池装置,下列说法不正确的是( )
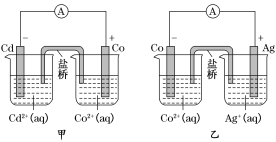
A. 甲中电池总反应的离子方程式为Cd(s)+Co2+(aq)=Co(s)+Cd2+(aq)
B. 盐桥的作用是形成闭合回路,并使两边溶液保持电中性
C. 反应2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq)能够发生
D. 乙电池中有1mol电子通过外电路时,正极有1mol Ag析出
【答案】C
【解析】
A.根据图片知,Cd失电子,Co2+得电子,所以其电池反应离子方程式为:Cd(s)+Co2+(aq)=Co(s)+Cd2+(aq),故A正确;
B.原电池放电时,盐桥中的阴阳离子定向移动而构成闭合回路,且使两溶液中电荷相等,所以盐桥的作用是形成闭合回路,并使两边溶液保持电中性,故B正确;
C.根据图片知,Cd失电子,Ag+得电子,所以2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq)反应不能发生,故C错误;
D.根据Cd(s)+2Ag+(aq)=2Ag(s)+Cd2+(aq)可知,当有lmol电子通过外电路时,正极有108gAg即1molAg析出,故D正确。
故选C。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)![]() pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
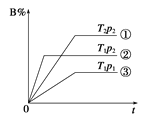
A.T1<T2 p1>p2 m+n>p 放热反应
B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应
D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置所示的实验中,不能达到实验目的是
|
|
|
|
A.长时间看到Fe(OH)2白色沉淀 | B.证明ρ(煤油)< ρ(钠) < ρ(水) | C.探究氧化性: KMnO4>Cl2>I2 | D.比较NaHCO3、Na2CO3的热稳定性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去),试回答下列问题:

(1)上述反应中生成二氧化硫的化学方程式为__。
(2)乙同学认为还可能产生氢气的理由是__。
(3)丙同学在安装好装置后,必须首先进行的一步操作是__。
(4)A中加入的试剂可能是__,作用是__;B中加入的试剂可能是__,作用是__;E中加入的试剂可能是__,作用是__。
(5)可以证明气体X中含有氢气的实验现象是:
C中:__,
D中:__。
如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?__(填“能”或“不能”),原因是_。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物麻黄碱和牛磺酸的结构简式如图。有关麻黄碱、牛磺酸的叙述正确的是
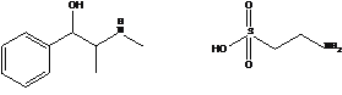
麻黄碱 牛磺酸
A.分子式分别为 C10H16ON、C2H7NO2S
B.均能发生取代反应,麻黄碱还能发生加成反应
C.均能与金属钠及氢氧化钠溶液反应
D.牛磺酸与HSCH2CH( NH2)COOH( 半胱氨酸) 互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物对环境、生产和人类生命活动等具有很大的影响。请按要求回答下列问题
(1)利用某分子筛作催化剂,NH3可脱除工厂废气中的NO、NO2,反应机理如下图所示。A包含物质为H2O和___________(填化学式)

(2)已知:4NH3(g)+6NO(g) =5N2(g)+6H2O(g) △H1=-a kJ/mol
4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H2=-b kJ/mol
H2O(l)=H2O(g) △H3=+c kJ/mol
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)的△H=___________ kJ/mol
(3)工业上利用氨气生产氢氰酸(HCN的反应为:CH4(g)+NH3(g)![]() HCN(g)+3H2(g ) △H>0
HCN(g)+3H2(g ) △H>0
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图甲所示。则X可以是___________(填字母序号)

a.温度 b.压强 c.催化剂 d.![]()
②在一定温度下,向2L密闭容器中加入 n mol CH4和2 moI NH3,平衡时NH3体积分数随n变化的关系如图乙所示。

a点时,CH4的转化率为___________%;平衡常数:K(a)_____K(b)(填“>”“=”或“<”)。
(4)肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,其反应原理可表示为: Mb(ag)+O2(g)![]() MbO2(aq),该反应的平衡常数可表示为:
MbO2(aq),该反应的平衡常数可表示为:![]() 。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[
。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[![]() ]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。

①试写出平衡常数K与速率常数k正、k逆之间的关系式为K=___________(用含有k正、k逆的式子表示)。
②试求出图丙中c点时,上述反应的平衡常数K=___________kPa-1。已知k逆=60s-1,则速率常数k正=___________s-1·kPa-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。根据已知信息回答下列问题:
(1)已知:P和Cl2分两步反应生成1mol PCl5的热化学方程式:
P(s)+3/2Cl2(g)![]() PCl3(g) △H1=-306kJ/mol
PCl3(g) △H1=-306kJ/mol
Cl2(g)+PCl3(g)![]() PCl5(g) △H2=-93kJ/mol
PCl5(g) △H2=-93kJ/mol
①P和Cl2一步反应生成1molPCl5的△H3=______________ kJ/mol。
②工业上制备PCl5通常也分两步进行,通常将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5,原因是____________________________________________。
③PCl5与足量水充分反应,最终生成两种酸,其中一种是P的最高价含氧酸,其化学方程
式是________________________________________________________。
(2)反应PCl3(g)+Cl2(g)![]() PCl5(g)在容积为10L的密闭容器中进行。起始时PCl3和Cl2均为0.2mol,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
PCl5(g)在容积为10L的密闭容器中进行。起始时PCl3和Cl2均为0.2mol,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
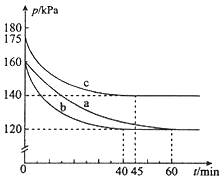
温馨提示:同温同容下的气体,压强之比就等于物质的量之比
①已知实验b平衡时气体的总物质的量为0.30mol,计算实验b反应开始至达到平衡时的反应速率v(PCl5)=_______________,PCl3的平衡转化率为__________________。
②图中3组实验从反应开始至达到平衡时的反应速率v(PCl5)由小到大的次序为____(填实验序号);与实验a相比,c组改变的实验条件是升高温度,判断依据是_________,若α表示PCl3的平衡转化率,实验a和c的平衡转化率:αa______αc(填“<”或“>”);b组改变的实验条件是加入了催化剂,判断依据是_______________________________。
③用p0表示开始时总压强,p表示平衡时总压强,则α(表示PCl3的平衡转化率)的表达式为____(用p0,p表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C又叫抗坏血酸,是一种水溶性维生素,只含有C、H、O三种元素,其球棍模型如图所示。下列关于维生素C的说法正确的是( )
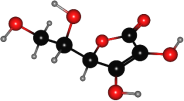
A.维生素C的分子式C6H8O6
B.维生素C含有1个手性碳原子
C.维生素C不能使溴水褪色
D.1mol维生素C与足量的钠反应能产生2molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沙丁胺醇是一种新型药物,常用于缓解哮喘等肺部疾病,其一种合成路线如图: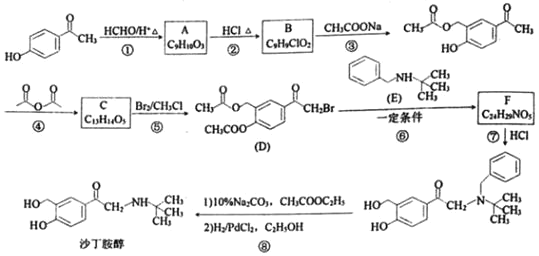
已知:RX+![]() →
→![]() +HX
+HX
请回答:
(1)化合物C的结构简式为___。
(2)反应⑦的化学方程式为___。
(3)下列说法不正确的是___。
A.化合物A能与FeCl3溶液发生显色反应
B.化合物B能发生消去反应
C.1 mol 化合物D最多能与3mol NaOH反应
D.沙丁胺醇的分子式为C13H19NO3
(4)写出同时符合下列条件的化合物E的所有同分异构体的结构简式___。
①IR谱表明分子中含有﹣NH2,且与苯环直接相连;
②1H﹣NMR谱显示分子中有五种不同化学环境的氢原子,且苯环上只有一种氢原子。
(5)请设计以甲苯和异丁烯[CH2=C(CH3)2]为原料合成化合物E的合成路线___(用流程图表示,无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com