
【题目】含氮化合物对环境、生产和人类生命活动等具有很大的影响。请按要求回答下列问题
(1)利用某分子筛作催化剂,NH3可脱除工厂废气中的NO、NO2,反应机理如下图所示。A包含物质为H2O和___________(填化学式)

(2)已知:4NH3(g)+6NO(g) =5N2(g)+6H2O(g) △H1=-a kJ/mol
4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H2=-b kJ/mol
H2O(l)=H2O(g) △H3=+c kJ/mol
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)的△H=___________ kJ/mol
(3)工业上利用氨气生产氢氰酸(HCN的反应为:CH4(g)+NH3(g)![]() HCN(g)+3H2(g ) △H>0
HCN(g)+3H2(g ) △H>0
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图甲所示。则X可以是___________(填字母序号)

a.温度 b.压强 c.催化剂 d.![]()
②在一定温度下,向2L密闭容器中加入 n mol CH4和2 moI NH3,平衡时NH3体积分数随n变化的关系如图乙所示。

a点时,CH4的转化率为___________%;平衡常数:K(a)_____K(b)(填“>”“=”或“<”)。
(4)肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,其反应原理可表示为: Mb(ag)+O2(g)![]() MbO2(aq),该反应的平衡常数可表示为:
MbO2(aq),该反应的平衡常数可表示为:![]() 。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[
。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[![]() ]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。

①试写出平衡常数K与速率常数k正、k逆之间的关系式为K=___________(用含有k正、k逆的式子表示)。
②试求出图丙中c点时,上述反应的平衡常数K=___________kPa-1。已知k逆=60s-1,则速率常数k正=___________s-1·kPa-1。
【答案】N2 ![]() bd 25 =
bd 25 = ![]() 2 120
2 120
【解析】
(1)根据流程图,可知NH3与废气中的NO、NO2反应产生氮气和水;
(2)根据盖斯定律,将已知的三个热化学方程式叠加,就得到相应的反应的热化学方程式;
(3)①CH4(g)+NH3(g)![]() HCN(g)+3H2(g ) △H>0的正反应是气体体积增大的吸热反应,根据X越大,NH3的转化率越小分析影响因素;
HCN(g)+3H2(g ) △H>0的正反应是气体体积增大的吸热反应,根据X越大,NH3的转化率越小分析影响因素;
②根据加入2molNH3、2molCH4时,利用三段式法,结合平衡时氨气含量是30%,计算出各种物质的平衡物质的量,再结合反应时二者消耗关系,可计算CH4的转化率;并根据化学平衡常数的含义计算此时反应平衡常数;
(4)①根据可逆反应达到平衡状态时,V正=V逆,结合平衡常数表达式计算K与K正、K逆的关系;
②将P(O2)=4.5kPa,肌红蛋白的结合度(a)是90%,带入平衡常数表达式可得K;将K=![]() 中的K、k逆带入可得k正。
中的K、k逆带入可得k正。
(1)根据流程图可知NH3与废气中的NO、NO2反应,最终产生无毒无害的氮气和水;
(2)①4NH3(g)+6NO(g) =5N2(g)+6H2O(g) △H1=-a kJ/mol
②4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H2=-b kJ/mol
③H2O(l)=H2O(g) △H3=+c kJ/mol
根据盖斯定律,将(①×2+②×3-③×30)×![]() ,整理可得4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H=
,整理可得4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H=![]() kJ/mol;
kJ/mol;
(3)①反应CH4(g)+NH3(g)![]() HCN(g)+3H2(g )的正反应是气体体积增大的吸热反应,根据图象可知:X越大,氨气的转化率越小。
HCN(g)+3H2(g )的正反应是气体体积增大的吸热反应,根据图象可知:X越大,氨气的转化率越小。
a.升高温度,化学平衡向吸热的正反应方向移动,使氨气的转化率增大,a错误;
b.增大压强,化学平衡向气体体积减小的逆反应方向移动,使氨气的转化率降低,b正确
c.催化剂只能改变反应速率,但不能使化学平衡发生移动,因此对氨气的转化率无影响,c错误;
d.增大![]() ,相对来说氨气增大的多,平衡正向移动,但平衡移动消耗量远远小于加入氨气的量,所以氨气的转化率降低,d正确;
,相对来说氨气增大的多,平衡正向移动,但平衡移动消耗量远远小于加入氨气的量,所以氨气的转化率降低,d正确;
故合理选项是ad;
②对于反应:CH4(g) + NH3(g)![]() HCN(g)+3H2(g ),假设反应消耗CH4物质的量为x
HCN(g)+3H2(g ),假设反应消耗CH4物质的量为x
开始(mol) 2 2 0 0
转化(mol) x x x 3x
平衡(mol) 2-x 2-x x 3x
根据图象可知在平衡时氨气的体积分数是30%,可得![]() =30%,解得x=0.5,则a点时,CH4的转化率为
=30%,解得x=0.5,则a点时,CH4的转化率为![]() =25%;
=25%;
由于温度不变,所以无论是在线上任何一点,化学反应的平衡常数都不变,因此K(a)=K(b);
(4)①可逆反应达到平衡状态时,V正=V逆,由于ν正=k正·c(Mb)· P(O2),ν逆=k逆·c(MbO2),所以k正·c(Mb)· P(O2)= k逆·c(MbO2),![]() ,而反应Mb(ag)+O2(g)
,而反应Mb(ag)+O2(g)![]() MbO2(aq)的平衡常数K=
MbO2(aq)的平衡常数K=![]() ;
;
②将C点时,P(O2)=4.5,肌红蛋白的结合度(a)是90%带入平衡常数表达式中可得K=![]() =2;
=2;
K=![]() ,由于K=2,k逆=60s-1带入该式子,可得k正=Kk逆=2×60s-1=120s-1。
,由于K=2,k逆=60s-1带入该式子,可得k正=Kk逆=2×60s-1=120s-1。


科目:高中化学 来源: 题型:
【题目】硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。完成下列填空:
(1)某些硅酸盐具有筛选分子的功能。一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期,两元素原子的质子数之和为24。
①写出M原子核外能量最高的电子的电子排布式:___________。
②常温下,不能与R单质发生反应的是_______(选填序号)。
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)氮化硅(Si3N4)陶瓷材料硬度大、熔点高。可由下列反应制得:SiO2+C+N2![]() Si3N4+CO
Si3N4+CO
①Si3N4中氮元素的化合价为-3,请解释Si3N4中氮元素化合价为负价的原因__________________。
②C3N4的结构与Si3N4相似,请比较二者熔点高低,并说明理由:______________________。
③配平上述反应的化学方程式,并标出电子转移的数目和方向。_______________。
(3)一种用工业硅(含少量铁、铜等金属的氧化物)制备Si3N4的主要流程如下:

①将工业硅粉碎的目的是______________________________。
②适量的H2是为了排尽设备中的空气,但H2在高温下也能还原工业硅中的某些金属化物。![]() 可能是______(选填:“盐酸”“硝酸”或“硫酸”),理由是_____________________。
可能是______(选填:“盐酸”“硝酸”或“硫酸”),理由是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗结肠炎药物Y结构如图所示,以下说法错误的是

A. 该有机物既能和酸反应又能和碱反应
B. 1mol该有机物可以和2molNaOH发生反应
C. 该有机物可以发生缩聚反应
D. 该有机物不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关性质的比较中,不正确的是
A. 硬度由大到小:金刚石>碳化硅>晶体硅
B. 晶格能:NaBr<NaCl<MgO
C. 键的极性:N-H<O-H<F-H
D. 熔点:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下,Ksp(CuS)=1.0×10-36,K sp(HgS)=1.6×10-52;pM=-lgc(M2+)。常温下,向10.0mL0.20mol·L-1Cu(NO3)2溶液中逐滴滴加0.10mo l·L-1Na2S溶液,溶液中pM与加入Na2S溶液的体积(V)的关系如图所示。下列说法错误的是

A. V0=20.0mL,m=18
B. 若c[Cu(NO3)2]=0.01mol·L-1,则反应终点可能为e点
C. a、b、d三点中,由水电离的c(H+)和c(OH-)的积最大的为b点
D. 相同条件下,若用等浓度等体积的Hg(NO3)2溶液代替上述Cu(NO3)2溶液,则反应终点b向c方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍及其化合物的应用正日益被重视。
(l)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的轨道表示式为______________________________。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有_____(填标号)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.都能与氢氧化钠溶液反应
(3)铍、镁晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点比镁的熔点高,原因是_____________________________________________________。
(4)氯化铍在气态时存在BeC12分子(a)和二聚分子(BeCl2)2(b),固态时则具有如图所示的链状结构(c)。

①a属于_____“极性”或“非极性”)分子。
②b中Be原子的杂化方式相同,且所有原子都在同一平面上。b 的结构式为________(标出配位键)。
③c中Be原子的杂化方式为_____。
④氯化铍晶体中存在的作用力有_____(填标号)。
A.范德华力 B.σ键 C.极性键 D.非极性键 E.离子键
(5)BeO立方晶胞如图所示。

①BeO晶体中,O2﹣的配位数为_____。
②若BeO晶体的密度为dg/cm3,BeO的摩尔质量为Mg·mol-1,阿伏伽德罗常数为NA,则晶胞参数a=_______________ cm (列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是A~G七种元素的电子排布
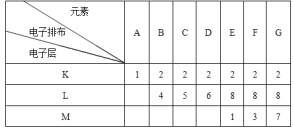
试由上述元素构成的物质的化学式回答:
(1)写出四种常见的由非极性键形成的双原子分子_____,
(2)写出三种由极性键形成的双原子分子___________,
(3)写出由极性键构成的直线形的三原子分子__,
(4)写出由三原子以极性键构成的空间构型为V形的三原子分子__,其电子式为___,
(5)写出一种由三个原子组成的既含离子键又含共价键的化合物___,其电子式为__________。
(6)写出一种既含离子键又含非极性键的化合物_____,其电子式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国的丹尼尔·诺切拉博士公布了自己团队研发的“人造树叶”,它可以与燃料电池共同构成一个新的发电装置——太阳能燃料电池,工作原理如图所示,下列有关叙述正确的是


A.太阳能燃料电池的优点为无论天气如何,均能持续供应电能,并且实现对环境的“零排放”
B.图A中塑料薄膜上部的反应为2H++2e-![]() H2↑
H2↑
C.图B燃料电池工作时的负极反应物为O2
D.“人造树叶”上发生的反应为6CO2+6H2O![]() C6H12O6+6O2
C6H12O6+6O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V L Fe2(SO4)3溶液中含有ag SO42-,取此溶液0.5V L,用水稀释至2V L,则稀释后溶液中Fe3+的物质的量浓度为( )
A.![]() mol·L-1B.
mol·L-1B.![]() mol·L-1C.
mol·L-1C.![]() mol·L-1D.
mol·L-1D.![]() mol·L-1
mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com