
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如下图所示,该电池电解质为6 mol·L-1KOH溶液,下列说法中正确的是( )
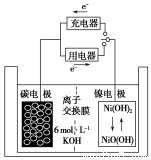
A.放电时K+移向负极
B.放电时电池负极的电极反应为:H2-2e-=2H+
C.放电时电池正极的电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH-
D.该电池充电时将碳电极与电源的正极相连
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.除去Cl2中少量的HCl,可将混合气体通过盛有饱和NaCl溶液的洗气瓶
B.向久置于空气的FeCl2溶液中滴入KSCN溶液,会产生Fe(SCN)3血红色沉淀
C.向某溶液中滴入稀盐酸产生使澄清石灰水变浑浊的气体,该溶液一定含有CO32-
D.实验室可采用分液法直接分离乙酸乙酯和乙醇的混合液
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练1 化学基本概念练习卷(解析版) 题型:选择题
某混合气体X,可能由H2、CO、CO2和水蒸气中的一种或几种组成,现将混合气体通入灼热的CuO,完全反应后,固体 CuO质量减少1.6 g;再将反应后的混合气体全部导入足量的澄清石灰水中,生成白色沉淀10 g。根据以上信息,分析下列有关X的组成推断正确的是( )
A.X一定只由CO组成
B.X一定只由H2和CO2组成
C.X可能由0.1 g H2和4.4 g CO2组成
D.X可能由0.1 g H2、1.4 g CO、2.2 g CO2组成
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷二(解析版) 题型:填空题
化合物X是一种环境激素,存在如下转化关系:
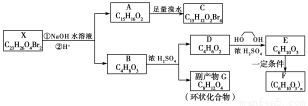
化合物A能与FeCl3溶液发生显色反应,分子中含有两个化学环境完全相同的甲基,其苯环上的一硝基取代物只有两种。1H?NMR谱显示化合物G的所有氢原子化学环境相同。F是一种可用于制备隐形眼镜的高聚物。
根据以上信息回答下列问题:
(1)下列叙述正确的是________。
a.化合物A分子中含有联苯结构单元
b.化合物A可以和NaHCO3溶液反应,放出CO2气体
c.X与NaOH溶液反应,理论上1 mol X最多消耗6 mol NaOH
d.化合物D能与Br2发生加成反应
(2)化合物C的结构简式是________,A→C的反应类型是________。
(3)写出同时满足下列条件的D的所有同分异构体的结构简式(不考虑立体异构)________________________________________________。
a.属于酯类 b.能发生银镜反应
(4)写出B→G反应的化学方程式__________________________________________________。
(5)写出E→F反应的化学方程式___________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷二(解析版) 题型:选择题
下列化合物中既能使溴的四氯化碳溶液褪色,又能在光照下与溴发 生取代反应的是( )
A.甲苯 B.乙醇 C.丙烯 D.乙烯
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷二(解析版) 题型:选择题
化学平衡常数(K)、电离常数(Ka)、溶度积常数(Ksp)是判断物质性质或变化的重要的常数。下列关于这些常数的说法中,正确的是( )
A.化学平衡常数的大小与温度、浓度、压强、催化剂有关
B.CH3COONH4溶液几乎呈中性,说明Ka(CH3COOH)与Kb(NH3·H2O)近似相等
C.Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-=AgI(s)+Cl-能够发生
D.Ka(HCN)<Ka(CH3COOH),说明相同浓度时,氢氰酸的酸性比醋酸强
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷一(解析版) 题型:填空题
现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E
分别同主族,D、E、F同周期。A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C可形成电子总数相等的分子,且A与C、A与E、A与F也可以形成电子总数相等的分子。
请回答下列问题:
(1)元素F在周期表中的位置________________________________________________。
(2)A、C、D三种元素可组成一种常见化合物,该化合物的化学式为________;工业生产该化合物和单质F的离子方程式为_________________________________________。
(3)B与F形成的化合物分子中,各原子最外层均达8电子结构,则该分子的电子式为________________________________________________________________________。
(4)已知0.50 mol EC2被C2氧化成气态EC3,放出49.15 kJ热量,其热化学方程式为_________________________________________________________________________。
(5)A、B、C以原子个数比4∶2∶3所形成的化合物,所含的化学键类型为____________。
0.1 mol·L-1该化合物水溶液中的离子浓度由大到小的顺序为_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷一(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA
B.0.1 mol·L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA
C.0.1 mol Zn与含0.1 mol HCl的盐酸充分反应,转移电子数目为0.2NA
D.标准状况下,18 g H2O所含的氧原子数目为NA
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-4练习卷(解析版) 题型:选择题
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是( )
A.Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
B.Cu2++H2S=CuS↓+2H+
C.Zn2++S2-+2H2O=Zn(OH)2↓+H2S↑
D.FeS+2H+=Fe2++H2S↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com