
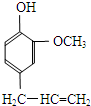
 某有机化合物A因其具有麻醉作用,常用作局部麻醉剂和镇痛剂.它的结构简式如右图所示,请回答:
某有机化合物A因其具有麻醉作用,常用作局部麻醉剂和镇痛剂.它的结构简式如右图所示,请回答: 2种,
2种, 中的一种.
中的一种.


科目:高中化学 来源: 题型:
A、 配制一定物质的量浓度的稀硫酸 |
B、 制取少量的Fe(OH)3胶体 |
C、 用H2SO4标准溶液滴定NaOH溶液 |
D、 称量NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
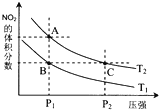 氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是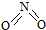 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的平均键能为466kJ?mol-1,N2O4中氮氧键的平均键能为438.5kJ?mol-1.
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的平均键能为466kJ?mol-1,N2O4中氮氧键的平均键能为438.5kJ?mol-1.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、拉瓦锡发现质量守恒定律、卢瑟福发现电子、波尔提出氢原子模型都对化学学科的发展作出了重要贡献 |
| B、实验室制备少量氢氧化铝可用下列方法:往AlCl3溶液中加入稍过量的氨水,抽滤,得到胶状沉淀经洗涤、晾干 |
| C、核磁共振、红外光谱、紫外光谱和质谱仪,均可用于分析有机物的结构 |
| D、维生素、PLA、油脂、甲壳素、硝化纤维都是高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com