

 ,故答案为:分子晶体;
,故答案为:分子晶体; ;
;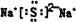 ,故答案为:
,故答案为: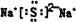 ;
;| 12.12×10-6 |
| 30×10-3 |
|
| 1.77×10-10 |
| 3.00×10-5 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
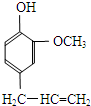 某有机化合物A因其具有麻醉作用,常用作局部麻醉剂和镇痛剂.它的结构简式如右图所示,请回答:
某有机化合物A因其具有麻醉作用,常用作局部麻醉剂和镇痛剂.它的结构简式如右图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 近年来,全球气候变暖给人类生存和发展带来了严峻的挑战,在此背景下,“新能源”、“低碳”、“节能减排”、“吃干榨尽”等概念愈来愈受到人们的重视.下列有关说法不正确的( )
近年来,全球气候变暖给人类生存和发展带来了严峻的挑战,在此背景下,“新能源”、“低碳”、“节能减排”、“吃干榨尽”等概念愈来愈受到人们的重视.下列有关说法不正确的( )| A、太阳能、地热能、生物质能和核聚变能均属于“新能源” |
| B、“低碳”是指采用含碳量低的烃类作为燃料 |
| C、如图甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想 |
| D、让煤变成合成气,把煤“吃干榨尽”,实现了煤的清洁、高效利用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com