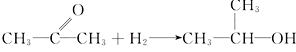��������һ�����ĩ����ըҩ����������ɣ��仯ѧ�ɷ�Ϊ��ѧ�����ļס������ֻ���������ֵ��ʣ�Ϊ��������ɣ�����������ʵ�飺
��ȡ29.14g���壬��һ�ܱ��������������������ұ�ը�����ɵ������ۺϳɱ�״���µ����Ϊ8.96L��������������N
2��CO
2�������Ϊ1��3��������������ʵ���=
=0.4mol������Ϊ
��0.4mol=0.1mol��������̼Ϊ0.4mol-0.1mol=0.3mol��
�ڽ��ٷ�Ӧ��Ĺ����������ˮ�ܽⲢ���ˣ���Һ��ֻ��һ�����α���ͨ�������������ɵ�3.21g����ɫ��������ɫ����ΪS�������ʵ���=
=0.1mol����ɫ��Ӧ����ɫ�ܲ����۲�������ɫ������KԪ�أ��ʱ�ΪK
2S�������ʵ���Ϊ0.1mol��
�۲����ڹ��˳�������2.14g��Ԫ�ط������������к�������Ԫ�أ������мײμӵ�ijһ������Ӧ����������˲��������������NaOH��Һ�У���ʣ1.12g���壬�ù�����һ�ֿɱ����������ĵ��ʶ������ڳ�ʪ�Ŀ������ױ���������ΪFe�������ʵ���=
=0.02mol�������������Al
2O
3��������=2.14g-1.12g=1.02g�����ʵ���=
=0.01mol���������Ϊ�������������ԭ���غ��֪������Fe��Oԭ����Ŀ֮��=0.02��0.01��3=2��3���ʼ�ΪFe
2O
3��ԭ�����ĩ�к���Al���ʣ�
���Ϸ����������������������ֵ��ʷ�Ӧ����K
2S��N
2��CO
2�����������ԭ��Ӧ��֪���������ֵ���ΪC��S����ԭ���غ��֪�������Һ���K��N��O����Ԫ�أ���K��N��Oԭ����Ŀ֮��=0.1��2��0.1��2��0.3��2=211��3������ΪKNO
3���ݴ˽��
���
�⣺��һ�����ĩ����ըҩ����������ɣ��仯ѧ�ɷ�Ϊ��ѧ�����ļס������ֻ���������ֵ��ʣ�Ϊ��������ɣ�����������ʵ�飺
��ȡ29.14g���壬��һ�ܱ��������������������ұ�ը�����ɵ������ۺϳɱ�״���µ����Ϊ8.96L��������������N
2��CO
2�������Ϊ1��3��������������ʵ���=
=0.4mol������Ϊ
��0.4mol=0.1mol��������̼Ϊ0.4mol-0.1mol=0.3mol��
�ڽ��ٷ�Ӧ��Ĺ����������ˮ�ܽⲢ���ˣ���Һ��ֻ��һ�����α���ͨ�������������ɵ�3.21g����ɫ��������ɫ����ΪS�������ʵ���=
=0.1mol����ɫ��Ӧ����ɫ�ܲ����۲�������ɫ������KԪ�أ��ʱ�ΪK
2S�������ʵ���Ϊ0.1mol��
�۲����ڹ��˳�������2.14g��Ԫ�ط������������к�������Ԫ�أ������мײμӵ�ijһ������Ӧ����������˲��������������NaOH��Һ�У���ʣ1.12g���壬�ù�����һ�ֿɱ����������ĵ��ʶ������ڳ�ʪ�Ŀ������ױ���������ΪFe�������ʵ���=
=0.02mol�������������Al
2O
3��������=2.14g-1.12g=1.02g�����ʵ���=
=0.01mol���������Ϊ�������������ԭ���غ��֪������Fe��Oԭ����Ŀ֮��=0.02��0.01��3=2��3���ʼ�ΪFe
2O
3��ԭ�����ĩ�к���Al���ʣ�
���Ϸ����������������������ֵ��ʷ�Ӧ����K
2S��N
2��CO
2�����������ԭ��Ӧ��֪���������ֵ���ΪC��S����ԭ���غ��֪�������Һ���K��N��O����Ԫ�أ���K��N��Oԭ����Ŀ֮��=0.1��2��0.1��2��0.3��2=211��3������ΪKNO
3��
��1��������������֪���ҵĻ�ѧʽΪKNO
3����ΪK
2S������ʽΪ��
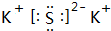
��
�ʴ�Ϊ��KNO
3��
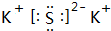
��
��2����ըҩ��ը��Ӧ�Ļ�ѧ����ʽΪ��S+2KNO
3+3C
K
2S+N
2��+3CO
2����
�ʴ�Ϊ��S+2KNO
3+3C
K
2S+N
2��+3CO
2����
��3��������������Ӧ�Ļ�ѧ����ʽΪ��2Al+Fe
2O
3Al
2O
3+2Fe���������������ǣ��ṩ��ը��Ӧ���������������
�ʴ�Ϊ��2Al+Fe
2O
3Al
2O
3+2Fe���ṩ��ը��Ӧ���������������
��4��Al���������������ȼ����������ȷ�Ӧ���ų��������ȣ��ʿ�����CuO������������
�ʴ�Ϊ��D��

 ��
��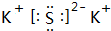 ��
��

 ��У����ϵ�д�
��У����ϵ�д�