
【题目】给盛有氯化钡稀溶液的甲、乙两支试管中分别通入SO2至饱和,若向甲试管中加入足量硝酸,乙试管中加入足量氢氧化钠溶液,则下列叙述正确的是( )
A.甲、乙两试管都有白色沉淀生成
B.甲、乙两试管都没有白色沉淀生成
C.甲试管没有白色沉淀生成而乙试管有
D.甲试管有白色沉淀生成而乙试管没有
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对比中学常见元素周期表,分析其元素的填充规律,判断下列说法正确的是( )
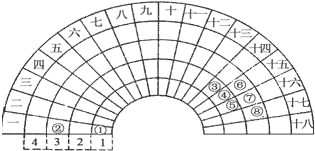
A. ③元素形成的单质晶体均属于原子晶体
B. ④元素的气态氢化物易液化,是因为其分子间存在氢键
C. ②、⑦、⑧对应的简单离子半径依次减小
D. ②⑤⑦三种元素形成的盐溶液在 25℃时的 pH值为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国女药学家屠呦呦因创制新型抗疟药——青蒿素(结构如图)和双氢青蒿素的贡献,挽救了全球特别是发展中国家的数百万人的生命”。青蒿素是从植物黄花蒿茎叶中提取的,荣获2015年诺贝尔奖生物学或医学奖。下列有关青蒿素的叙述不正确的是

A. 分子式为C15H22O5
B. 它在乙醚中的溶解度大于在水中的溶解度
C. 能发生取代反应、水解反应、加成反应,不能发生氧化反应
D. 该物质不稳定,容易受到热和还原性物质的影响而发生变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是一种重要的化工原料,主要成分是CuFeS2,另外还有少量的氧化铝、二氧化硅及水分,通过化学工艺可获得许多化工产品。
(1)铜元素位于元素周期表中_________(填写周期、族);基态Fe原子的价层电子轨道表达式为_____;
(2)硫位于第VIA 族,该族元素氢化物沸点由低到高的顺序及原因是_________(必要化学用语及文字简答)。
(3)基态氮原子的第一电离能大于氧原子的第一电离能的原因是__________。
(4)由铝和氯元素组成的化合物熔点190℃、在熔融态不导电;该化合物易升华,其蒸气密度是相同条件下氢气的133.5倍。请写出其蒸气分子的结构式______________(如有配位键,请 用“→”表 示 )。(5)黄铜矿在空气中高温灼烧可以得到固体混合物和废气,固体混合物中有X和Y两化合物。固体化合物X的晶胞模型如图甲所示:
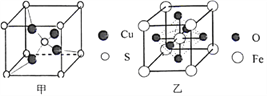
①化合物X的化学式:___________;
②废气中SO2经催化氧化生成SO3,SO3分子中硫原子杂化方式为___________;SO3分子空间构型是___________。
(6)黄铜矿高温灼烧得到的另一固体化合物Y的晶胞模型如图乙,已知丫晶体密度为ρg/cm3,则Y 晶体中晶胞边长是_____cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13;B的化合物种类繁多,数目庞大;C、D 是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1:1的原子个数比形成的化合物的电子式:_______ ,F的原子结构示意图为_______。
(2)B、D形成的化合物 BD2中存在的化学键为_______ 键(填“离子”或“共价”,下同),A、C、F三种元素形成的化合物CA4F为_______化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性,则甲、乙反应的离子方程式为_______。
(4)A、C、D、E的原子半径由大到小的顺序是_______(用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性_______于F(填“强”或“弱”),并用化学方程式证明上述结论_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①固定好滴定管F并使滴定管尖嘴充满液体;
②用蒸馏水洗涤碱式滴定管F,并立即注入NaOH溶液至“0”刻度线以上;
③用标准液滴定至终点,记下滴定管液面读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤调节液面至“0”或“0”刻度线稍下,并记下读数。
请回答:
(1)以上步骤合理的顺序为(填编号)____________________,
(2)排去碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
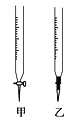

(3)滴定管F中应该选择右图中滴定管_____(填标号)。
(4)错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)
A.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗___________;
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确___________;
C.用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液___________;
D.配制标准溶液的NaOH中混有KOH杂质___________;
(5)滴定操作中,左手_____________,右手______________,眼睛应观察(填编号)_________A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(6)判断滴定终点的现象是:锥形瓶中溶液______________________________;
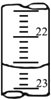
(7)如下图是某次滴定时的滴定管中的液面,其读数为________mL;
(8)根据下列数据:请计算待测盐酸溶液的浓度:______mol/L。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类生产和生活中必不可少的重要金属(如图)。

(1)自然界一共存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,其中58Fe原子中子数与质子数之差为___。计算铁元素的近似相对质量的计算式为:54×a1%+56×a2%+57×a3%+58×a4%,其中a1%、a2%…是指各同位素的____。
(2)铁原子中有___种能量不同的电子,铁原子次外层的电子云有____种不同的伸展方向。
(3)与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为_________________。
(4)要用铁片、锌片、直流电源和导线完成铁片镀锌的实验,铁片应置于阴极,电解质溶液是____。
(5)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+,配平制取高铁酸钠的化学方程式:___Fe(NO3)3+___NaOH+____Cl2→___Na2FeO4+ ___NaNO3+___NaCl+___H2O;高铁酸钠除了能消毒杀菌外,还能吸附水中的悬浮物,其原因是_______________。
(6)0.03mol的铁加到过量的 HNO3中,加热,铁完全溶解,若生成 NO、NO2的混和气体共1.12L(标准状况),将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体全部溶于水生成HNO3,则通入O2的体积_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种有机物有如下转化关系。已知B可以发生银镜反应,D气体密度是氢气的14倍。
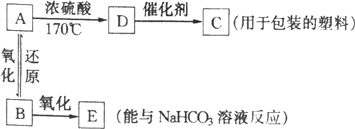
根据图示,
(1)试写出A、C、E的结构简式:A_____、C_______、E________。
(2)写出下列反应的化学方程式:
A→D:_______________________;
A→B: _______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
(1)T℃时,在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。

①反应2min到5min,用氢气表示的平均反应速率v(H2)=_____________。
②下列说法正确的是_____________(填字母序号)。
A.达到平衡时,CO的转化率为50%
B.5min后容器中压强不再改变
C.达到平衡后,再充入氩气,反应速率增大
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
E.加入催化剂可以加快化学反应速率,同时提高CO和H2平衡的转化率
③下列叙述可以说明该反应在该条件下已经达到化学平衡的是__________(填字母序号)。
A.混合气体密度不发生改变 B.混合气体的平均相对分子质量不再发生改变
C.v(CO)正=2v(H2)逆 D.n(CO)与n(H2)的比值不变
(2)某温度下,在一容积可变的恒压密闭容器中分别充入1molCO和1.2molH2,达到平衡时容器体积为2L,且含有0.5molCH3OH(g),则该反应平衡常数的值为_______,此时向容器中再通入0.3molCO和0.3mo1CH3OH(g),则此平衡将______________(填“向正反应方向”、“不”或“向逆反应方向”)移动。
(3)若压强、投料比x=n(CO)/n(H2)对反应的影响如图二所示,则图中曲线所示的压强关系:p1_____p2(填“=”“>”或“<”)。
(4)工业上另一种合成甲醇的方法是利用CO2和H2,已知:CH3OH、H2的燃烧热(△H)分別为-726.9kJ/mol、-285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com