
| A、向Al2(SO4)3溶液中滴加过量的NaOH溶液制备Al(OH)3 |
| B、向水玻璃中滴加盐酸制备硅酸 |
| C、用加热法除去Ca(OH)2固体中混有的NH4Cl固体 |
| D、SO2通入酸性KMnO4溶液检验其漂白性 |


科目:高中化学 来源: 题型:
| A、0.1 mol/L Na2CO3溶液,c(CO32-)与c(Na+)之比 |
| B、0.1 mol/L与0.2 mol/L 醋酸溶液,c(H+) 之比 |
| C、pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比 |
| D、pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:
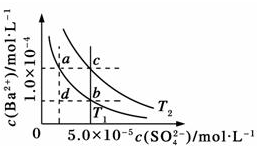
| A、T1>T2 |
| B、加入BaCl2固体,可使a点变成c点 |
| C、c点时,在T1、T2两个温度下均有固体析出 |
| D、a点和b点的Ksp相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象与结论 |
| 步骤1: | 部分固体不溶解 |
| 步骤2: | |
| 步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色.取少量固体于试管中,滴加过量HCl后,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN. |
查看答案和解析>>
科目:高中化学 来源: 题型:
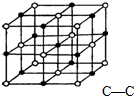 科学家最近发现一种由钛原子和碳原子构成的气态团簇分子,如图1所示:图中顶角和面心的原子都是钛原子,棱的中心和体心的原子都是碳原子该分子的化学式是( )
科学家最近发现一种由钛原子和碳原子构成的气态团簇分子,如图1所示:图中顶角和面心的原子都是钛原子,棱的中心和体心的原子都是碳原子该分子的化学式是( )| A、Ti13C114 |
| B、Ti14C113 |
| C、Ti4C5 |
| D、TiC |
查看答案和解析>>
科目:高中化学 来源: 题型:

 的化学方程式
的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com