
| A. | 溶液中含有OH- | B. | 与氯化铵溶液反应放出氨气 | ||
| C. | 与金属铝反应放出氢气 | D. | 滴入甲基橙试液后,溶液呈黄色 |
分析 水溶液中都含有H+和OH-,溶液酸碱性取决于H+和OH-的浓度的相对大小:[H+]>[OH-]溶液呈酸性;[H+]=[OH-]溶液呈中性;[H+]<[OH-]溶液呈碱性;
室温时,Kw=10-14,若溶液中:[H+]=10-7,pH值=7,溶液呈中性;[H+]>10-7,pH值<7,溶液呈酸性;:[H+]<10-7,pH值>7,溶液呈碱性,据此分析解答.
解答 解:A.任何电解质溶液中都含有H+和OH-,不能根据溶液中含有OH-而确定溶液酸碱性,故A错误;
B.碱和氯化铵反应生成氨气,则该溶液一定呈碱性,故B正确;
C.非强氧化性酸和强碱溶液都能和铝反应生成氢气,所以能与铝反应生成氢气的溶液可能呈酸性也可能呈碱性,故C错误;
D.甲基橙的变色范围为3.1-4.4,则滴入甲基橙呈黄色的溶液可能呈酸性、中性或碱性,故D错误;
故选B.
点评 本题考查电解质溶液酸碱性判断,为高频考点,明确酸碱性溶液判断标准是解本题关键,温度未知时不能根据溶液pH判断酸碱性,题目难度不大.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
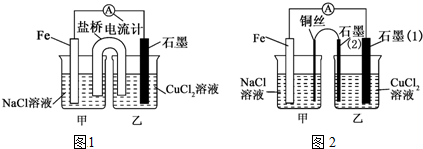
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 “埃博拉”病毒的形状宛如中国古代的“如意”(如图).病毒的基本化学组成是核酸和蛋白质.有的病毒还含有脂质、糖类等其他组分.下列有关有机物的说法不正确的是( )
“埃博拉”病毒的形状宛如中国古代的“如意”(如图).病毒的基本化学组成是核酸和蛋白质.有的病毒还含有脂质、糖类等其他组分.下列有关有机物的说法不正确的是( )| A. | 漂白粉、双氧水都可以杀灭埃博拉病毒 | |
| B. | 组成病毒的糖类、酯类和蛋白质在一定条件下都可发生水解反应 | |
| C. | 酯在酸性条件下的水解反应属于取代反应,也属于可逆反应 | |
| D. | 糖类和蛋白质的燃烧产物不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠能与冷水剧烈反应,而铝不能与冷水反应 | |
| B. | NaOH易溶于水,Al(OH)3难溶于水 | |
| C. | 等物质的量的NaOH和Al(OH)3,Al(OH)3可以电离出更多OH- | |
| D. | 等物质的量铝比钠失去电子数多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH和C3H4 | B. | CH4和C3H4O | C. | CH4和C2H4 | D. | CH4和C3H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中离子浓度关系为:c (Na+)>c(HCO3-)>c (OH-)>c(H+) | |
| B. | 25℃时,加水稀释后,$\frac{c(O{H}^{-})}{c({H}^{+})}$变小 | |
| C. | 温度升高,c(OH-)×c(H+)不变(忽略体积变化) | |
| D. | 溶液中c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
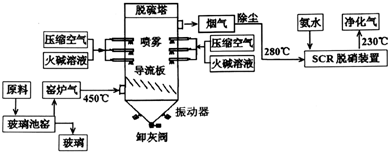
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
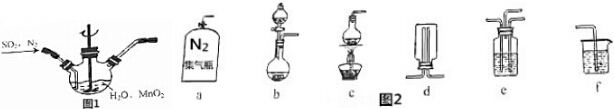
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com