
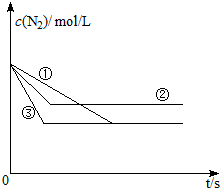
 氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
| ||
| △c |
| t |
| ||
| 1 |
| 3 |
| △c |
| t |
| 9mol/L |
| 60min |
| 96 |
| 12 |
| 66 |
| 62 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、向AgC1悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgCl+S2-=Ag2S↓+2Cl- |
| B、切开的金属Na暴露在空气中,光亮表面逐渐变暗4Na+O2=2Na2O |
| C、Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+2CO2=2Na2CO3+O2 |
| D、向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
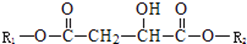 (其中R1、R2为未知部分的结构),已知X可以发生如图所示的转化:
(其中R1、R2为未知部分的结构),已知X可以发生如图所示的转化: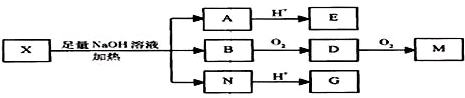
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 操作 | 现象及解释 |
| A | 过量铁粉逐渐加入到一定量的浓硝酸中 | 溶液最终变为浅绿色是因为浓硝酸变稀后,稀硝酸只能把铁氧化成Fe2+:Fe+2H+═Fe2++H2↑ |
| B | 向水杨酸(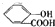 )中液加NaHCO3溶液 )中液加NaHCO3溶液 | 放出无色气体是因为水杨酸的酸性强于碳酸,反应生成CO2气体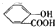 +2HCO3-═ +2HCO3-═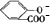 +2CO2↑+2H2O, +2CO2↑+2H2O, |
| C | 利用右边装置完成碳酸、醋酸和硅酸的酸性强弱比较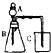 | B中固体溶解并产生气泡,C中出现白色沉淀是因为酸性:醋酸碳酸大于硅酸;B中离子方程式:CaCO3+2H+═Ca2++CO2↑+H2O |
| D | 含有等浓度的SO42-和CO32-的溶液中滴加BaCl2溶液,将沉淀一分为二,一份经检验只含BaSO4,另一份放入饱和碳酸钠溶液一段时间,取出沉淀洗涤后放入盐酸中 | 放入盐酸中的沉淀溶解,且有气泡产生是因为Ksp[BaSO4]=1.1×10-30<Ksp[BaCO3]=5.1×10-9,因此SO42-先沉淀.但二者溶度积相差不大,BaSO4(s)+CO32-?BaCO3(s)+SO42- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、CO2、CO、NO2都是酸性氧化物 |
| B、Na2O、Na2O2、Fe2O3、CuO都是碱性氧化物 |
| C、HCl、HClO、HNO3、HClO4都是强酸 |
| D、NaOH、KOH、Ba(OH)2、Ca(OH)2都是强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原N2、H2混合气体为1.0V L |
| B、原N2、H2混合气体为1.2V L |
| C、参加反应的N2为0.1V L |
| D、原混合气体中N2、H2体积比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此回答下列问题:
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com