
【题目】当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,这在节能减排、降低碳排放方面具有重大意义。
回答下列问题:
(1)该反应的化学方程式为___________________________。
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是___________(填序号)。
a.体系压强不再改变
b.H2的浓度不再改变
c.气体的密度不随时间改变
d.单位时间内消耗H2和CO2的物质的量之比为3∶1
(3)已知:1 g氢气完全燃烧生成液态水,放出143 kJ热量;23 g乙醇完全燃烧生成液态水和二氧化碳,放出650 kJ热量,则氢气和乙醇的燃烧热的比值为____________(要求计算出数值)。
(4)在一定压强下,测得由CO2制取CH3CH2OH的实验数据中,起始投料比、温度与CO2的转化率的关系如图所示。

根据图中数据分析:
①降低温度,平衡向________________方向移动。
②在700 K、起始投料比![]() =1.5时,H2的转化率为______________。
=1.5时,H2的转化率为______________。
③在500 K、起始投料比![]() =2时,达到平衡后H2的浓度为a mol·L1,则达到平衡时CH3CH2OH的浓度为___________。
=2时,达到平衡后H2的浓度为a mol·L1,则达到平衡时CH3CH2OH的浓度为___________。
【答案】(1)2CO2+6H2![]() C2H5OH+3H2O
C2H5OH+3H2O
(2)ab (3)0.22
(4)①正反应(或右) ②40% ③1.5a mol·L1
【解析】(1)由题给信息可得该反应的化学方程式为2CO2+6H2![]() C2H5OH+3H2O。
C2H5OH+3H2O。
(2)该反应为气体分子数减小的化学反应,当体系的压强不再改变时,反应达到平衡状态,另外氢气的浓度不再变化,也能说明反应达到平衡状态;由于在500 K时,所有物质均为气体,故在恒容状态下气体的密度恒为定值,密度不变不能说明反应达到平衡状态;根据化学方程式可知,任何单位时间内消耗H2和CO2的物质的量之比均为3∶1。
(3)由题给信息可分别写出氢气和乙醇燃烧的热化学方程式:H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH=286 kJ/mol 和CH3CH2OH(l)+3O2(g)
H2O(l) ΔH=286 kJ/mol 和CH3CH2OH(l)+3O2(g)![]() 2CO2(g)+3H2O(l) ΔH=1 300 kJ/mol,从而可求得氢气和乙醇的燃烧热的比值为0.22。
2CO2(g)+3H2O(l) ΔH=1 300 kJ/mol,从而可求得氢气和乙醇的燃烧热的比值为0.22。
(4)①由图中信息可知,其他条件不变时,升高温度,CO2的转化率降低,说明平衡向逆反应方向移动,故正反应为放热反应,即降低温度,平衡将向正反应方向移动。
②700 K时,当氢气与二氧化碳的起始投料比![]() =1.5时,由图像可知二氧化碳的转化率为20%,由化学方程式:2CO2+6H2
=1.5时,由图像可知二氧化碳的转化率为20%,由化学方程式:2CO2+6H2![]() C2H5OH+3H2O,可计算出氢气的转化率为40%。
C2H5OH+3H2O,可计算出氢气的转化率为40%。
③设起始时c(CO2)=x mol·L1,则起始时c(H2)=2x mol·L1,有
2CO2+6H2![]() C2H5OH+3H2O
C2H5OH+3H2O
起始浓度(mol·L1):x 2x 0 0
转化浓度(mol·L1): 0.6x 1.8x 0.3x 0.9x
平衡浓度(mol·L1): 0.4x 0.2x 0.3x 0.9x
0.2x=a,得x=5a,平衡时c(CH3CH2OH)=0.3x mol·L1=1.5a mol·L1。


科目:高中化学 来源: 题型:
【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |

(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
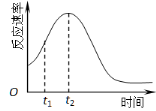 (5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:

① ;② 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列10种物质:①饱和食盐水;②乙醇;③铁片;④液态硫酸;⑤碳酸钙固体⑥干冰;⑦熔融硫酸钾;⑧铝条;⑨烧碱;⑩石墨。
(1)用序号回答,能导电的是_____。属于电解质的是_____。属于非电解质的是_____。
(2)写出③与水反应的化学方程式,并用单线桥表示电子转移的方向和数目__________。
(3)写出⑧与⑨的水溶液反应的离子方程式是_______________________。
(4)储氢纳米碳管的成功研制体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质-碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O 七种。请用上述物质填空并配平化学方程式:
C +_____ +□H2SO4-□ +□ +□Cr2(SO4)3+□H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在等温等压条件下,化学反应方向的判据为:ΔH-TΔS<0 反应能正向自发进行,ΔH-TΔS=0 反应达到平衡状态, ΔH-TΔS>0 反应不能自发进行。设反应A=D+E ΔH-TΔS=(-4 500+11T) J·mol-1,要防止反应发生,温度必须( )
A.高于409 KB.低于136 K
C.高于136 K而低于409 KD.低于409 K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 碳酸钙跟醋酸反应:CaCO3+2H+===Ca2++CO2↑+H2O
B. 金属钠加入到CuSO4溶液中:2Na+Cu2+===Cu+2Na+
C. 铁跟稀盐酸反应:Fe+2H+===Fe2++H2↑
D. 碳酸氢钙溶液跟足量烧碱溶液反应:Ca2++HCO![]() +OH-===CaCO3↓+H2O
+OH-===CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号。请回答下列问题。

(1)请将分类依据代号填入相应的括号内:
(____)两种物质都不是电解质
(____)两种物质都是钠的化合物
(____)两种物质都属于氧化物
(____)两种物质都属于盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1 mol·L-1的如图中某种物质M的水溶液,继续煮沸可制得一种红褐色胶体。
①物质M的化学式为____________。
②证明有红褐色胶体生成的实验方法是___________________(不需要回答具体操作方法)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某核素的质量数为37,该核素质子数、中子数和电子数正确的顺序是( )
A. 18、19、19 B. 18、20、18
C. 19、18、20 D. 18、19、18
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究“二氧化碳是否在有水存在时才能和过氧化钠反应”,某课题研究小组的同学们设计了如下图的实验装置,分别进行了甲、乙两次实验:
实验甲:干燥的二氧化碳和过氧化钠的反应。在干燥的试管Ⅱ中装入Na2O2,在通入CO2之前,关闭K1和K2。在试管Ⅰ内装入试剂X后,打开K1和K2,通入CO2,几分钟后,将带火星的木条插入试管Ⅲ的液面上,观察到木条不复燃,且Ⅱ中的淡黄色没有变化。
实验乙:潮湿的二氧化碳和过氧化钠的反应。在试管Ⅰ内装入试剂Y,其他操作同实验甲,观察到木条复燃,且Ⅱ中的淡黄色变为白色。

试回答下列问题:
(1)在装入Na2O2后,通入CO2前,关闭K1和K2的目的是_________________________________________________________。
(2)在实验甲中,试剂X是______________;在实验乙中,试剂Y是_____________。
(3)根据上述两个实验现象,得到的结论是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是中学实验室常用的试剂,可以用来制备氢氧化铁胶体。
(1)下列制备氢氧化铁胶体的操作方法正确的是____________(填字母);
A.向饱和氯化铁溶液中滴加少量的氢氧化钠稀溶液
B.加热煮沸氯化铁饱和溶液
C.在氨水中滴加氯化铁浓溶液
D.在沸水中滴加饱和氯化铁溶液,煮沸至液体呈红褐色
(2)写出制备氢氧化铁胶体的离子方程式_______________;
(3)下列与胶体性质无关的是_____________(填字母);
A.河流入海口处形成沙洲
B.使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血
C.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
D.在饱和氯化铁溶液中滴加NaOH溶液,产生红褐色沉淀
E.冶金厂常用高压电除去烟尘
(4)从溶液中分离提纯Fe(OH)3胶体的方法叫_____________;
(5)向氢氧化铁胶体中逐滴加入稀硫酸至过量的现象是_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com