
【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |

(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
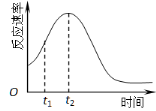 (5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:

① ;② 。
【答案】(10分)
(1)2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(2)浓度;①<②
(3)0.0056
(4)KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间
(5)①该反应放热;②产物Mn2+是反应的催化剂
【解析】
试题分析:(1)酸性KMnO4和H2C2O4反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)对比①②实验可探究浓度对化学反应速率的影响,②中A溶液的浓度比①中大,化学反应速率大,所得CO2的体积大,故答案为:浓度;①<②;
(3)CO2的物质的量是:![]() =0.0001mol,设2min末,反应的MnO4-的物质的量为x
=0.0001mol,设2min末,反应的MnO4-的物质的量为x
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
2 10
x 0.0001mol
解得 x=0.00002mol,30×10-3L×0.01mol/L-0.00002mol=0.00028mol,c(MnO4-)=![]() =
=![]() =0.0056mol/L,故答案为:0.0056;
=0.0056mol/L,故答案为:0.0056;
(4)通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率,故答案为:KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间;
(5)温度越高,反应速率越快,该反应可能是放热反应;催化剂能加快化学反应的速率,产物Mn2+(或MnSO4)是反应的催化剂,故答案为:①该反应放热;②产物Mn2+是反应的催化剂


科目:高中化学 来源: 题型:
【题目】现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下。回答下列问题(注:Na2O2可以与H2O、CO2反应):

(1)装置Ⅳ中盛放的药品是________,其作用是_______________________________。
(2)若规定气体的气流方向从左到右,则组合实验装置时各件仪器的正确连接顺序为(各仪器接口的标号字母顺序):空气进入 g ,________接________,________接________,________接________(用字母表示)。
(3)装置Ⅱ的作用_____________________________________________。
(4)操作中通空气和加热的顺序为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择下列物质填空
(1)①蔗糖溶液 ②盐酸 ③NH3 ④熔融BaSO4 ⑤Fe(OH)3胶体 ⑥液态HCl ⑦NH3·H2O ⑧金刚石 ⑨Cu。能导电的物质是______________,电解质是______________,非电解质是____________。
(2)已知3.01×1024个氖原子的质量为w g,则氖气的摩尔质量是_________。
(3)将V1L 0.1mol/L NaOH溶液与V2L 0.3mol/L Ba(OH)2溶液混合,所得溶液OH-浓度为0.3mol/L,如果混合后体积为混合前的体积和,则V1︰V2= ____________。
(4)气体化合物A分子式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择下列物质填空
(1)①蔗糖溶液 ②盐酸 ③NH3 ④熔融BaSO4 ⑤Fe(OH)3胶体 ⑥液态HCl ⑦NH3·H2O ⑧金刚石 ⑨Cu。能导电的物质是______________,电解质是______________,非电解质是____________。
(2)已知3.01×1024个氖原子的质量为w g,则氖气的摩尔质量是_________。
(3)将V1L 0.1mol/L NaOH溶液与V2L 0.3mol/L Ba(OH)2溶液混合,所得溶液OH-浓度为0.3mol/L,如果混合后体积为混合前的体积和,则V1︰V2= ____________。
(4)气体化合物A分子式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的数值,下列叙述正确的是
①标况下2.24L己烷中,含1.4NA个C-H键
②常温常压下,16gO2和O3混合气体中,电子数为8NA
③过氧化钠与水反应,产生3.2g氧气,则电子转移数目为0.2NA
④0.1mol/LKAl(SO4)2溶液中含Al3+数目小于0.1NA
⑤将0.1molFeCl3配成氢氧化铁胶体,胶体粒子数目最多可达到0.1NA
⑥将2.8gN2与足量氢气充分反应,得到氨气分子数目少于0.2NA
A. ①②④⑥ B. ③④⑤⑥
C. ②③⑥ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 :
A.化学反应一定只伴随热量的变化
B.凡是吸热或放热过程中热量的变化均称为反应热
C.若△H<0,则反应物的总能量高于生成物的总能量
D.若△H>0,则反应物的总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无砂粘土而为之”,“凡坯既成,干燥之后,则堆积窖中燃薪举火”,“浇水转釉(主要为青色),与造砖同法”。下列说法错误的是
A. 粘土是制作砖瓦和陶瓷的主要原料
B. “燃薪举火”使粘土发生复杂的物理化学变化
C. 沙子和粘土的主要成分均为硅酸盐
D. 烧制后自然冷却成红瓦,浇水冷却成青瓦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,这在节能减排、降低碳排放方面具有重大意义。
回答下列问题:
(1)该反应的化学方程式为___________________________。
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是___________(填序号)。
a.体系压强不再改变
b.H2的浓度不再改变
c.气体的密度不随时间改变
d.单位时间内消耗H2和CO2的物质的量之比为3∶1
(3)已知:1 g氢气完全燃烧生成液态水,放出143 kJ热量;23 g乙醇完全燃烧生成液态水和二氧化碳,放出650 kJ热量,则氢气和乙醇的燃烧热的比值为____________(要求计算出数值)。
(4)在一定压强下,测得由CO2制取CH3CH2OH的实验数据中,起始投料比、温度与CO2的转化率的关系如图所示。

根据图中数据分析:
①降低温度,平衡向________________方向移动。
②在700 K、起始投料比![]() =1.5时,H2的转化率为______________。
=1.5时,H2的转化率为______________。
③在500 K、起始投料比![]() =2时,达到平衡后H2的浓度为a mol·L1,则达到平衡时CH3CH2OH的浓度为___________。
=2时,达到平衡后H2的浓度为a mol·L1,则达到平衡时CH3CH2OH的浓度为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com