
【题目】选择下列物质填空
(1)①蔗糖溶液 ②盐酸 ③NH3 ④熔融BaSO4 ⑤Fe(OH)3胶体 ⑥液态HCl ⑦NH3·H2O ⑧金刚石 ⑨Cu。能导电的物质是______________,电解质是______________,非电解质是____________。
(2)已知3.01×1024个氖原子的质量为w g,则氖气的摩尔质量是_________。
(3)将V1L 0.1mol/L NaOH溶液与V2L 0.3mol/L Ba(OH)2溶液混合,所得溶液OH-浓度为0.3mol/L,如果混合后体积为混合前的体积和,则V1︰V2= ____________。
(4)气体化合物A分子式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为________。
【答案】 ②④⑤⑨ ④⑥⑦ ③ ![]() g·mol-1 3︰2 O3F2
g·mol-1 3︰2 O3F2
【解析】(1)含有自由移动电子或离子的物质可以导电,能导电的物质是盐酸、熔融BaSO4、Fe(OH)3胶体、Cu;溶于水或在熔融状态下能够自身电离出离子的化合物是电解质,属于电解质的是熔融BaSO4、液态HCl、NH3·H2O;于水和在熔融状态下都不能够自身电离出离子的化合物是非电解质,属于非电解质是氨气;(2)已知3.01×1024个氖原子的质量为w g,物质的量是3.01×1024÷6.02×1023/mol=5.0mol,则氖气的摩尔质量是![]() 。(3)根据混合过程中氢氧根的物质的量不变可知
。(3)根据混合过程中氢氧根的物质的量不变可知![]() ,解得V1︰V2=3︰2;(4)同温同压下10mLA受热分解生成15mLO2和10mLF2,则根据阿伏加德罗定律可知2OxFy=3O2+2F2,因此根据原子守恒可知A的化学式为O3F2。
,解得V1︰V2=3︰2;(4)同温同压下10mLA受热分解生成15mLO2和10mLF2,则根据阿伏加德罗定律可知2OxFy=3O2+2F2,因此根据原子守恒可知A的化学式为O3F2。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】“低碳经济,节能减排”是当今世界经济发展的新思路.”下列与之相悖的是
A. 着力开发风能、太阳能、地热能等清洁高效新能源,减少煤、石油等化石燃料的使用
B. 为了减少SO2和NOx的排放,工业废气排放到大气之前必须回收处理
C. 大力开采煤、石油和天然气,以满足经济发展和日常生活的需要
D. 大力发展混合动力汽车、电动汽车等新能源汽车,以减少对化石能源的依赖,保护城乡环境,关爱人类生存空间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g) + 3H2(g) ![]() 2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。请回答下列问题:
2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。请回答下列问题:

(1)上图中属于氢气物质的量随时间变化的曲线是_____________(填“I”、“II”或“Ⅲ”)。
(2)关于t2时刻的说法正确的是______。
A.t2时该反应达到平衡状态 b.t2时II和III代表的物质反应速率相同
c.t2时氢气、氮气与氨气的反应速率之比为3:1:2 D.t2时氨气与氢气的物质的量相同
(3)对于II所代表的物质,其逆反应速率最大的点是__________(填“c”、“d”或“g”);对于I所代表的物质,其正反应速率最小的点是___________ (填“a”、“e”或“f”)。
(4)其他条件不变,只改变温度,在改变的这个温度下反应至t3时刻,此时n(H2)比图象中的值大,那么该温度可能是____________(填序号)。
A.673 K B.273 K C.373 K
(5)在密闭容器中充入2 mol N2和6 mol H2,—定条件下建立平衡:N2(g) + 3H2(g) ![]() 2NH3(g) △H=-92.2kJ/mol,测得 N2 的转化率为 90%,则在此条件下,反应放出的热量为___________kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应_________(填“放出”或“吸收”)的热量为___________kJ。
2NH3(g) △H=-92.2kJ/mol,测得 N2 的转化率为 90%,则在此条件下,反应放出的热量为___________kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应_________(填“放出”或“吸收”)的热量为___________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应的是
A. 2Na+2H2O![]() 2NaOH+H2↑+Cl2↑ B. NaOH+HCl═NaCl+H2O
2NaOH+H2↑+Cl2↑ B. NaOH+HCl═NaCl+H2O
C. CaO+H2O═Ca(OH)2 D. NH4Cl![]() NH3↑+HCl↑
NH3↑+HCl↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立足教材实验是掌握高中化学实验的基础,是理解化学科学的实验原理、实验方法和实验思路,提高学生实验能力的基本途径:
(1)实验1:取一块金属钠,在玻璃片上用滤纸吸干表面的煤油后,用小刀切去一端的外皮,观察钠的颜色,这个实验中还需用到的一种仪器是_________;
(2)实验2:向一个盛有水的小烧杯里滴入几滴酚酞试液,然后把一小块钠投入小烧杯,把反应的现象和相应结论填入空格,“浮”--钠的密度比水小;“红”--反应生成了氢氧化钠;“熔”——______________;
(3)实验3:用坩埚钳夹住一小块用砂纸仔细打磨过的铝,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释正确的是_________
A.火焰温度太低不能使铝燃烧 B.铝在空气中能很快形成氧化膜
C.氧化铝的熔点比倡的熔点高 D.打磨砂纸不能除去表面的氧化膜
(4)实验4:把少量水滴入盛有Na2O2固体的试管中,立即用带火星的木条放在试管口,检验
生成的气体体,向反应后的溶液中加入酚酞试液,可以看到__________;
(5)实验5:在玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,该氧化还原反应的氧化剂是__________,该反应每消耗1mol铁,转移电子的物质的量为_________。
(6)实验6:在试管中注入少量新制备的FeSO4溶液,用胶头滴管吸取NaOH溶液,将滴管尖端插入试管里溶液底部,慢慢挤出NaOH溶液,可以看到开始时析出一种白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色,发生这种颜也变化的原因是(用化学方程式表示):______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cl-、Br-、Fe2+、I-的还原性依次增强。现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示,请回答:

(1)c线分别代表溶液中____________的变化情况;
(2)原溶液中Fe2+与Br-的物质的量之比为____________;
(3)当通入2mol Cl2时,溶液中离子反应为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) ![]() 2NO2(g) ΔH,随温度升高,混合气体的颜色变深。
2NO2(g) ΔH,随温度升高,混合气体的颜色变深。

回答下列问题:
(1)反应的ΔH__________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,平均反应速率v(NO2)为__________molL-1s-1,反应的平衡常数K为____________________________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4) 以0.0020 molL-1s-1的平均速率降低,经10 s又达到平衡。则T__________100℃(填“大于”或“小于”)。
(3)利用图(a)和(b)中的信息,按图(b)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是_____________________________。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |

(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
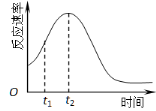 (5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:

① ;② 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列10种物质:①饱和食盐水;②乙醇;③铁片;④液态硫酸;⑤碳酸钙固体⑥干冰;⑦熔融硫酸钾;⑧铝条;⑨烧碱;⑩石墨。
(1)用序号回答,能导电的是_____。属于电解质的是_____。属于非电解质的是_____。
(2)写出③与水反应的化学方程式,并用单线桥表示电子转移的方向和数目__________。
(3)写出⑧与⑨的水溶液反应的离子方程式是_______________________。
(4)储氢纳米碳管的成功研制体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质-碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O 七种。请用上述物质填空并配平化学方程式:
C +_____ +□H2SO4-□ +□ +□Cr2(SO4)3+□H2O。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com