
【题目】下列叙述正确的是 :
A.化学反应一定只伴随热量的变化
B.凡是吸热或放热过程中热量的变化均称为反应热
C.若△H<0,则反应物的总能量高于生成物的总能量
D.若△H>0,则反应物的总能量高于生成物的总能量
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g) + 3H2(g) ![]() 2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。请回答下列问题:
2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。请回答下列问题:

(1)上图中属于氢气物质的量随时间变化的曲线是_____________(填“I”、“II”或“Ⅲ”)。
(2)关于t2时刻的说法正确的是______。
A.t2时该反应达到平衡状态 b.t2时II和III代表的物质反应速率相同
c.t2时氢气、氮气与氨气的反应速率之比为3:1:2 D.t2时氨气与氢气的物质的量相同
(3)对于II所代表的物质,其逆反应速率最大的点是__________(填“c”、“d”或“g”);对于I所代表的物质,其正反应速率最小的点是___________ (填“a”、“e”或“f”)。
(4)其他条件不变,只改变温度,在改变的这个温度下反应至t3时刻,此时n(H2)比图象中的值大,那么该温度可能是____________(填序号)。
A.673 K B.273 K C.373 K
(5)在密闭容器中充入2 mol N2和6 mol H2,—定条件下建立平衡:N2(g) + 3H2(g) ![]() 2NH3(g) △H=-92.2kJ/mol,测得 N2 的转化率为 90%,则在此条件下,反应放出的热量为___________kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应_________(填“放出”或“吸收”)的热量为___________kJ。
2NH3(g) △H=-92.2kJ/mol,测得 N2 的转化率为 90%,则在此条件下,反应放出的热量为___________kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应_________(填“放出”或“吸收”)的热量为___________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) ![]() 2NO2(g) ΔH,随温度升高,混合气体的颜色变深。
2NO2(g) ΔH,随温度升高,混合气体的颜色变深。

回答下列问题:
(1)反应的ΔH__________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,平均反应速率v(NO2)为__________molL-1s-1,反应的平衡常数K为____________________________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4) 以0.0020 molL-1s-1的平均速率降低,经10 s又达到平衡。则T__________100℃(填“大于”或“小于”)。
(3)利用图(a)和(b)中的信息,按图(b)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是_____________________________。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |

(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
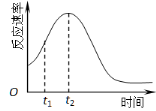 (5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:

① ;② 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是___(填序号),配制上述溶液还需用到的玻璃仪器是____________(填仪器名称)。
(2)下列操作中,容量瓶所不具备的功能有______(填序号)。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体 D.准确稀释某一浓度的溶液
E.量取一定体积的液体 F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度______0.1 mol·L-1(填“大于”“等于”或“小于”,下同)。
(4)根据计算可知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾和浓盐酸之间有下列反应:2KClO3 + 4HCl(浓)== 2 KCl + Cl2↑+ 2ClO2 + 2H2O。
(1)该反应中发生还原反应的物质是__________。氧化产物是___________。
(2)用双线桥标出方程式中的电子得失___________。
2KClO3 + 4HCl(浓)== 2 KCl + Cl2↑+ 2ClO2 + 2H2O
(3)当有0.2mol电子发生转移时,生成的氯气的体积为_____L(标准状况)。被氧化的HCl的物质的量为____mol。
(4)若分别用①KMnO4(还原产物是Mn2+)②MnO2(还原产物是Mn2+)③Ca(ClO)2(还原产物是Cl2)氧化浓盐酸制备氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列10种物质:①饱和食盐水;②乙醇;③铁片;④液态硫酸;⑤碳酸钙固体⑥干冰;⑦熔融硫酸钾;⑧铝条;⑨烧碱;⑩石墨。
(1)用序号回答,能导电的是_____。属于电解质的是_____。属于非电解质的是_____。
(2)写出③与水反应的化学方程式,并用单线桥表示电子转移的方向和数目__________。
(3)写出⑧与⑨的水溶液反应的离子方程式是_______________________。
(4)储氢纳米碳管的成功研制体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质-碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O 七种。请用上述物质填空并配平化学方程式:
C +_____ +□H2SO4-□ +□ +□Cr2(SO4)3+□H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某核素的质量数为37,该核素质子数、中子数和电子数正确的顺序是( )
A. 18、19、19 B. 18、20、18
C. 19、18、20 D. 18、19、18
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com