
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32﹣、SO42﹣、Cl﹣中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( ) 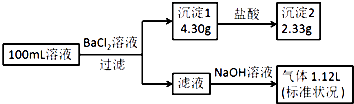
A.原溶液一定存在CO32﹣和SO42﹣ , 一定不存在Fe3+
B.原溶液一定存在Cl﹣ , 可能存在Na+
C.原溶液中c(Cl﹣)≥0.1molL﹣1
D.若原溶液中不存在Na+ , 则c(Cl﹣)<0.1molL﹣1
【答案】D
【解析】解:加入氯化钡溶液,生成沉淀,一定含有碳酸根或是硫酸根中的至少一种,则该沉淀为BaSO4、BaCO3中的至少一种,沉淀部分溶解于盐酸,所以一定是BaSO4、BaCO3的混合物,一定存在CO32﹣、SO42﹣ , 硫酸钡沉淀是2.33g,物质的量是 ![]() =0.01mol,碳酸根离子的物质的量是
=0.01mol,碳酸根离子的物质的量是 ![]() mol=0.01mol,碳酸根和铁离子不共存,一定不存在Fe3+ , 所得到的滤液中加入氢氧化钠,出现气体,为氨气,一定含有铵根离子,根据元素守恒,铵根离子的物质的量是
mol=0.01mol,碳酸根和铁离子不共存,一定不存在Fe3+ , 所得到的滤液中加入氢氧化钠,出现气体,为氨气,一定含有铵根离子,根据元素守恒,铵根离子的物质的量是 ![]() =0.05mol,根据电荷守恒,阳离子所带正电荷的物质的量之和:0.05mol,阴离子所带负电荷的物质的量之和=0.01×2+0.01×2=0.04mol,所以一定存在氯离子,钠离子不能确定,n(Cl﹣)≥0.01mol,所以c(Cl﹣)≥0.1molL﹣1 . A、原溶液一定存在CO32﹣和SO42﹣、Cl﹣ , 一定不存在Fe3+ , 故A正确;
=0.05mol,根据电荷守恒,阳离子所带正电荷的物质的量之和:0.05mol,阴离子所带负电荷的物质的量之和=0.01×2+0.01×2=0.04mol,所以一定存在氯离子,钠离子不能确定,n(Cl﹣)≥0.01mol,所以c(Cl﹣)≥0.1molL﹣1 . A、原溶液一定存在CO32﹣和SO42﹣、Cl﹣ , 一定不存在Fe3+ , 故A正确;
B、原溶液一定存在Cl﹣ , 可能存在Na+ , 故B正确;
C、原溶液中c(Cl﹣)≥0.1molL﹣ , 故C正确;
D、若原溶液中不存在Na+ , 则c(Cl﹣)=0.1molL﹣1 , 故D错误.
故选D.


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质.已知:甲+乙=丁+己,甲+丙=戊+己; 丁溶液为短周期元素中最高价氧化物对应水化物中碱性最强的物质.下列说法正确的是( )
A.原子半径:W>Z>Y>X
B.Y元素在周期表中的位置为第三周期第ⅣA族
C.1mol甲与足量的乙完全反应共转移了1mol电子
D.甲、乙、丙、丁、戊、己中含有的共价键的物质只有乙、丙、己
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: 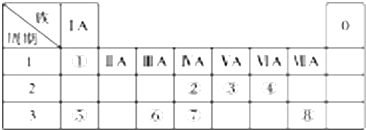
(1)地壳中含量最高的金属元素⑥在周期表中的位置是 .
(2)⑧形成的单质与水反应的离子方程式为 .
(3)②⑦的非金属性强弱可通过比较这两种元素(填编号) a.原子的得电子的能力 b.含氧酸的酸性
c.气态氢化物的稳定性 d.单质的熔沸点
(4)写出一种由④⑤⑧元素形成的既含有离子键又含有共价键的物质的电子式 .
(5)元素⑤与⑧形成的化合物属于(填“离子化合物”、“共价化合物”),用电子式表示该化合物的形成过程: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程中,原物质分子内共价键被破坏,同时有离子键形成的是 ( )
A. 盐酸和NaOH溶液混合 B. 氯化氢溶于水
C. 溴化氢气体与氨气相遇反应 D. 锌和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A. 原子的核外电子层数等于该元素所在的周期数
B. 元素周期表中从第ⅢB族到第ⅡB族的10列元素都是金属元素
C. 稀有气体元素原子的最外层电子数都是8个
D. 主族元素原子最外层电子数等于族序数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于卤素单质(X2)的下列叙述中正确的是
A. 都能与氢气化合发生爆炸B. 都能与水剧烈反应
C. 都能与钠反应生成NaXD. 都能与铁反应生成FeX3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在11.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成21.4g沉淀,则下列表示X组成的选项中合理的是( )
A.0.3mol NO2
B.0.3mol NO、0.1mol NO2
C.0.6mol NO
D.0.3mol NO2、0.1mol NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A的分子式为C3H4O2 , 结构中含羧基.试写出它与下列物质反应的方程式.
(1)氢氧化钠溶液 .
(2)溴水 .
(3)乙醇 .
(4)氢气 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com