
| A. | 1mol任何气体的体积约是22.4L | |
| B. | 标准状况下,1mol H2O 所占的体积约为22.4L | |
| C. | 常温常压下,1mol O2 所占的体积约为22.4L | |
| D. | 标准状况下,体积为22.4LN2 和N2O 的混合气体,其中约含有2mol N 原子 |
分析 A.气体的体积受温度、压强的影响;
B.标准状况下水为液体;
C.常温常压下气体的摩尔体积不是22.4L/mol;
D.根据n=$\frac{V}{{V}_{m}}$计算.
解答 解:A.气体的体积受温度、压强的影响,一般在标准状况下为22.4L,故A错误;
B.标准状况下水为液体,1mol H2O 所占的体积约为约为18mL,故B错误;
C.常温常压下气体的摩尔体积不是22.4L/mol,故C错误;
D.标准状况下,体积为22.4LN2 和N2O 的混合气体为1mol,含有2molN原子,故D正确.
故选D.
点评 本题综合考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握气体摩尔体积的使用范围,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L Cl2溶于水,转移的电子数目小于 NA | |
| B. | 常温常压下,18 g H2O中含有的原子总数为3 NA | |
| C. | 0.1 moI•L-1的CH3COOH溶液中所含的离子和分子总数为0.1NA | |
| D. | 乙烯和聚乙烯组成的14 g混合物中原子总数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1硫酸溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| B | H2S通入CuSO4溶液中 | 溶液中出现黑色沉淀 | 酸性:H2S>H2SO4溶液 |
| C | 在CuSO4溶液中加入KI溶液,再加入苯,振荡、静置 | 有白色沉淀生成,苯层呈紫红色 | 白色沉淀可能为CuI |
| D | 将一小块钠投入到CuSO4溶液中 | 有无色无味的气体放出,且出现蓝色沉淀 | 氧化性:H+>Cu2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
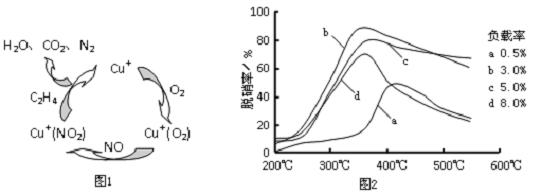
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol•L-1的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol•L-1的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
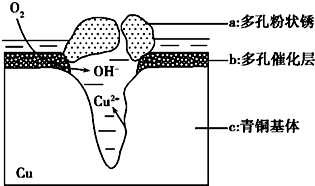 如图1为青铜器在潮湿环境中发生的电化学腐蚀的示意图.
如图1为青铜器在潮湿环境中发生的电化学腐蚀的示意图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=-867 kJ•mol-1 | |
| B. | CH4催化还原NOx为N2的过程中,若x=1.6,则转移电子3.2 mol | |
| C. | 若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移电子3.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O和N2O | B. | CS2和SiO2 | C. | CH4和NH3 | D. | CO2和N2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com