
【题目】I.![]() 是“84”消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用,请回答下列问题。
是“84”消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用,请回答下列问题。
(1)![]() 属于_____________(填:氧化物,碱,盐)。
属于_____________(填:氧化物,碱,盐)。
(2)浸泡衣物时加入“84”消毒液在空气中放置一段时间漂白效果更好,原因用离子方程式表示为:______________。(已知酸性:![]() -)
-)
(3)若将“84”消毒液与洁厕灵(主要成分是盐酸)混合使用,则会产生黄绿色的有毒气体,其反应的离子方程式是_______。
II.Cl2是一种有毒气体,如果泄漏会造成严重的危害。
(4)已知:![]() ,化工厂可用浓氨水来检验Cl2是否泄漏。该反应中被氧化和未被氧化的
,化工厂可用浓氨水来检验Cl2是否泄漏。该反应中被氧化和未被氧化的![]() 的物质的量比_______。
的物质的量比_______。
(5)喷射石灰乳等碱性物质可以减轻少量Cl2泄漏造成的危害。Cl2和石灰乳反应的化学方程式是:_____。
【答案】盐 ![]()
![]() 1:3
1:3 ![]()
【解析】
(1)由金属阳离子与酸根离子构成,则NaClO属于盐;答案为盐。
(2)发生强酸制取弱酸的反应,生成HClO,离子方程式为ClO-+H2O+CO2=HClO+HCO3-,反应生成了HClO,漂白效果会更好;答案为:ClO-+H2O+CO2=HClO+HCO3-。
(3)将“84”消毒液与洁厕灵(主要成分是盐酸)混合使用,发生氧化还原反应生成氯气,离子反应为ClO-+Cl-+2H+=Cl2↑+H2O,氯气有毒,所以把“84”消毒液和某清洁剂(含盐酸)混合使用会发生中毒事故;答案为:ClO-+Cl-+2H+=Cl2↑+H2O。
(4)在3Cl2+8NH3=6NH4Cl+N2反应中,N元素的化合价由反应前NH3中的-3价变为反应后N2的0价,化合价升高,失去电子,被氧化,NH3作还原剂,根据化学方程式可知,8molNH3参加反应,有2mol作还原剂,有6mol的NH3未被氧化,所以该反应中被氧化的NH3和未被氧化的NH3的物质的量比为2:6=1:3;答案为:1:3。
(5)Cl2和石灰乳反应产生CaCl2、Ca(ClO)2和水,反应的化学方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;答案为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。


科目:高中化学 来源: 题型:
【题目】救灾物资中的一瓶“84消毒液”的包装说明上有如下信息:含25%NaClO(次氯酸钠)、1000 mL、密度1.19 g/cm3,稀释100倍(体积比)后使用。
请回答下列问题:
(1)上述“84消毒液”的物质的量浓度为___mol/L。
(2)该同学取100 mL上述“84消毒液”,稀释后用于消毒,稀释100倍后的溶液中c(Na+)=___mol/L(假设稀释后溶液密度为1.0 g/cm3),该消毒液长时间放置在空气中能吸收标准状况下CO2的体积为____L。(已知:酸性:H2CO3> HClO> HCO3-)
(3)灾区志愿者根据上述“84消毒液”的包装说明,欲用NaClO固体(NaClO易吸收空气中的H2O、CO2)配制480 mL含25%NaClO的消毒液。下列说法正确的是___。
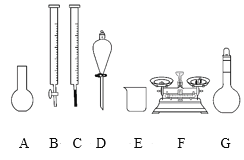
a.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
b.容量瓶用蒸馏水洗净后,要烘干才能用于溶液的配制
c.利用购买的商品NaClO来配制可能会导致结果偏低
d.需要NaClO固体的质量为143g
(4)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN-bmg/L,现用ClO2将CN-氧化,只生成两种无毒气体,其离子反应方程式为_____,处理100 m3这种污水,至少需要ClO2_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月1日,在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF-31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料包含了Fe、Cr、Ni、C等多种元素。回答下列问题:
(1)基态铁原子的价电子排布式为___。
(2)与Cr同周期且基态原子最外层电子数相同的元素,可能位于周期表的___区。
(3)实验室常用KSCN溶液、苯酚(![]() )检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为___(用元素符号表示),苯酚中碳原子的杂化轨道类型为___。
)检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为___(用元素符号表示),苯酚中碳原子的杂化轨道类型为___。
(4)铁元素能于CO形成Fe(CO)5。羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1mol Fe(CO)5分子中含___molσ键,与CO互为等电子体的一种离子的化学式为___。
(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的___空隙和___空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B(![]() ,0,
,0,![]() ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___。
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___。
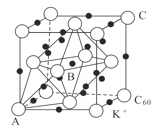
(6)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体中Ni2+与Ni3+的最简整数比为___,晶胞参数为428pm,则晶体密度为___g/cm3(NA表示阿伏加德罗常数的值,列出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
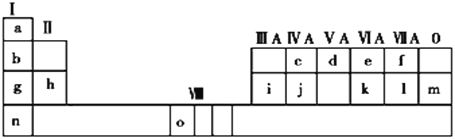
试回答下列问题:
(1)请写出元素o的基态原子电子排布式_______。
(2)d的氢化物的分子构型为_____;k在空气中燃烧产物的中心原子的杂化形式为____,该分子是______(填“极性”或“非极性”)分子。
(3)由j原子跟c原子以1∶1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是_____(填具体物质),试从结构角度加以解释______
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
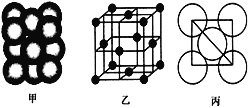
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为______。
②该晶体的密度为______ (用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):
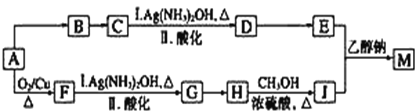
已知:①E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同化学环境的氢原子,其个数比为3∶1;
②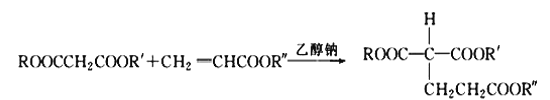 (R、R′、R″代表相同或不相同的烃基)。
(R、R′、R″代表相同或不相同的烃基)。
(1)A分子中的含氧官能团的名称是_________。
(2)A→B反应所需的试剂是_________。
(3)G→H反应的化学方程式是______。
(4)已知1 mol E与2 mol J反应生成1 mol M,则M的结构简式是________。
(5)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有_______种,其中任意1种的结构简式是__________。
(6)J可合成高分子化合物,该高分子化合物的结构简式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的含量影响钢铁性能。一种测定硫含量的方法是将钢样中硫转化为二氧化硫气体,再用测硫装置进行测定。某测定硫含量的流程如下:
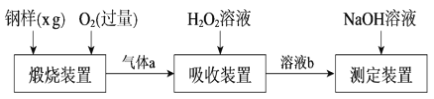
(1)气体a的主要成分有CO2、______、______。
(2)若钢样中硫以FeS的形式存在,煅烧装置中发生的化学反应为3FeS+5O2 ![]() 1______ +3______。___________
1______ +3______。___________
(3)吸收装置中,H2O2氧化SO2的化学方程式是_________________。
(4)用NaOH溶液中和生成的溶液b,消耗z mLNaOH溶液,若消耗1 mLNaOH溶液相当于硫的质量为y g,则该钢样中硫的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组的同学利用如图所示装置探究二氧化硫气体的性质。请回答:
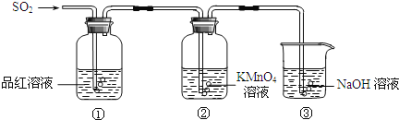
(1)实验室用铜和浓硫酸共热制取二氧化硫,反应的化学方程式是____。
(2)当观察到②中溶液颜色变浅时,①中的现象是____。
(3)装置③的作用是___。
(4)①中的现象说明二氧化硫具有的性质是___。
(5)②中的现象说明二氧化硫具有的性质是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一种同位素X原子的质量数为A,它与2H原子组成2HmX分子,此分子含N个中子,在a g 2HmX中所含电子的物质的量是
A. ![]() (A-N+m) molB.
(A-N+m) molB. ![]() (A-N) mol
(A-N) mol
C. ![]() (A-N+m) molD.
(A-N+m) molD. ![]() (A-N+2m) mol
(A-N+2m) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯胺![]() 是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
已知:①![]() 和NH3相似,与盐酸反应生成易溶于水的盐
和NH3相似,与盐酸反应生成易溶于水的盐![]()
②用硝基苯制取苯胺的反应原理: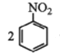 +3Sn+12HCl
+3Sn+12HCl![]()
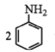 +3SnCl4+4H2O
+3SnCl4+4H2O
③有关物质的部分物理性质见下表:
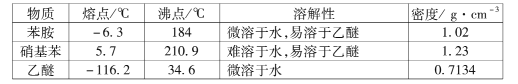
I.比较苯胺与氨气的性质
(1)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近,产生白烟,反应的化学方程式为____;用苯胺代替浓氨水重复上述实验,却观察不到白烟,原因是____。
Ⅱ.制备苯胺
往图1所示装置(夹持装置略,下同)的冷凝管口分批加入20mL浓盐酸(过量),置于热水浴中回流20min,使硝基苯充分还原;冷却后,往三颈烧瓶中滴入一定量50% NaOH溶液,至溶液呈碱性。
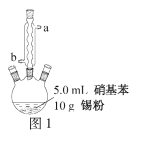
(2)冷凝管的进水口是____(填“a”或“b”);
(3)滴加NaOH溶液的主要目的是析出苯胺,反应的离子方程式为____。
Ⅲ.提取苯胺
i.取出图1所示装置中的三颈烧瓶,改装为图2所示装置。加热装置A产生水蒸气,烧瓶C中收集到苯胺与水的混合物;分离混合物得到粗苯胺和水溶液。
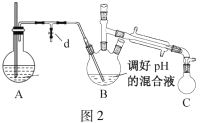
ii.往所得水溶液中加入氯化钠固体,使溶液达到饱和状态,再用乙醚萃取,得到乙醚萃取液。
iii.合并粗苯胺和乙醚萃取液,用NaOH固体干燥,蒸馏后得到苯胺2.79g。
(4)装置B无需用到温度计,理由是____。
(5)操作i中,为了分离混合物,取出烧瓶C前,应先打开止水夹d,再停止加热,理由是____。
(6)该实验中苯胺的产率为____。
(7)欲在不加热条件下除去苯胺中的少量硝基苯杂质,简述实验方案:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com