
【题目】下表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是 ( )

X | Y | Z | |
① | Cu | CuO | Cu(OH)2 |
② | CH3CH2OH | CH3CHO | CH2=CH2 |
③ | Na2CO3 | NaOH | NaHCO3 |
④ | CaCO3 | CaO | Ca(OH)2 |
A.②③ B.③④ C.②④ D.①②
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下列有机物的命名正确的是( )
A. 3-甲基-2-乙基戊烷
3-甲基-2-乙基戊烷
B.(CH3)3CCH2CH(C2H5)CH3 2,2-二甲基-4-乙基戊烷
C. 邻甲基苯酚
邻甲基苯酚
D. 2-甲基-3-戊炔
2-甲基-3-戊炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定已部分变质的过氧化钠样品的纯度,设计如图所示的实验装置,图中Q为弹性良好的气球(不与药品反应),称取一定量的样品放入其中。按如图所示的装置安装好仪器,打开分液漏斗的活塞,将稀硫酸滴入气球中。

请回答下列问题:
(1)Q内发生反应生成________种气体,
其中的反应有________个为氧化还原反应。
(2)为测定反应时生成气体的总体积,滴稀H2SO4前必须关闭________(填“K1”、“K2”或“K3”),打开______(填“K1”、“K2”或“K3”)。
(3)当上述反应停止时,将K1、K2、K3均关闭,然后先打开K2,再缓缓打开K1,这时可观察到的现象是 。
(4)b中装的固体试剂是__________,需缓缓打开K1的原因为 。
(5)实验结束时,量筒Ⅰ中有x mL水,量筒Ⅱ中收集到y mL气体,则过氧化钠的纯度是 (用含x、y的式子表示,上述体积均已折算成标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 500 g CuSO 4 溶液中插入两根电极,一极为铜,一极为粗铜(含锌)。通电电解至粗铜刚好全部溶解掉,这时铜极质量增加 7.04g,电解质溶液质量增加 0.02g。求粗铜中含锌的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3是一种化工原料,可以通过反应生成一系列物质,如下图所示。

下列说法正确的是( )
A.Cl2和SO2均可以漂白有色物质,且漂白的原理相同
B.由SiO2+Na2CO3![]() Na2SiO3+CO2↑可知,H2CO3的酸性强于H2SiO3
Na2SiO3+CO2↑可知,H2CO3的酸性强于H2SiO3
C.工业上,可先向饱和食盐水中通人NH3达饱和后,再通入CO2制NaHCO3
D.制取玻璃、纯碱和漂白粉所涉及的反应都是非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为保护环境,减少汽车尾气中污染物的排放量,政府规定,新车必须安装三元尾气处理装置。
(1)三元尾气处理装置是利用催化剂将汽车尾气中的三种主要污染物转化为无污染的气体。汽车尾气中三种主要大气污染物是:NOx、________和________。试写出在催化剂作用下,氨气还原NO2的化学方程式:_____________________,在该反应中氧化产物和还原产物的物质的量之比为________。
(2)北京市拟用甲醇替代液化石油气作为公交车的燃料,甲醇作为汽车燃料的好处是_______________,写出甲醇燃烧的化学方程式:_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:
N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。,
2NH3(g) ΔH=-92.4 kJ·mol-1。,
在定容2升密闭容器中,使2 mol N2和6 mol H2混合发生反应,平衡时N2转化率为20%:
当反应达到平衡时,H2的浓度是
目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应,
CO2(g)+3H2(g) ![]() CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:

从反应开始到平衡,氢气的平均反应速率v(H2)=_________________
500℃达平衡时,CH3OH(g)的体积分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于________硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂添加时先加________后加________,原因是______________________。
(3)目前常用阳离子交换树脂如NaR、HR来进行水的软化,若使用HR作为阳离子交换树脂,则水中的Ca2+、Mg2+与交换树脂的________起离子交换作用。若使用NaR作为阳离子交换树脂,失效后可放入5%~8%________溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO等离子,电极为惰性电极。请分析下列问题:
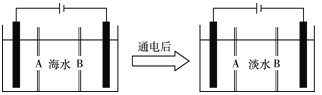
① 阳离子交换膜是指________(填A或B)。
②写出通电后阳极区的电极反应式:__________;阴极区的现象是:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
X | Y | Z | |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | KOH溶液 | SiO2 | 浓盐酸 |
③ | O2 | N2 | H2 |
④ | FeCl3溶液 | Cu | 浓硝酸 |
A. ①③ B. ①④ C. ②④ D. ②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com