
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:
N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。,
2NH3(g) ΔH=-92.4 kJ·mol-1。,
在定容2升密闭容器中,使2 mol N2和6 mol H2混合发生反应,平衡时N2转化率为20%:
当反应达到平衡时,H2的浓度是
目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应,
CO2(g)+3H2(g) ![]() CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:

从反应开始到平衡,氢气的平均反应速率v(H2)=_________________
500℃达平衡时,CH3OH(g)的体积分数为 。
【答案】2.4mol/L 0.225mol/(L·min) 30﹪
【解析】
试题分析:氮气的转化率为20%,则氮气反应的物质的量为2×20%=0.4摩尔,则氢气的变化量为1.2摩尔,则剩余氢气的物质的量为6-1.2=4.8摩尔,平衡时氢气的浓度为4.8/2=2.4mol/L 从图分析,10分钟内,甲醇的浓度变化量为0.75,则根据方程式分析,氢气的浓度变化量为0.75×3=2.25 mol/L,则氢气的反应速率为2.25/10= 0.225mol/(L·min) 平衡时甲醇的浓度为0.75 mol/L,一氧化碳的浓度为0.25 mol/L,氢气的浓度为3-2.25=0.75 mol/L,水蒸气的浓度为0.75 mol/L,则甲醇的体积分数为0.75/(0.25+0.75+0.75+0.75)=30﹪。


科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法不正确的是
A. 元素周期表有7个横行,每一横行是一周期
B. 元素周期表有18个纵行,每一纵行是一族
C. 第IIA族元素全部是金属元素
D. 第VIIA族元素全部是非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现给你一试管二氧化氮,其他药品和仪器自选。试设计实验,要求尽可能多地使二氧化氮被水吸收。
实验步骤 | 现象 | 解释(可用化学方程式表示) | |
(1) | |||
(2) | |||
(3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是 ( )

X | Y | Z | |
① | Cu | CuO | Cu(OH)2 |
② | CH3CH2OH | CH3CHO | CH2=CH2 |
③ | Na2CO3 | NaOH | NaHCO3 |
④ | CaCO3 | CaO | Ca(OH)2 |
A.②③ B.③④ C.②④ D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24L三氯甲烷中含有的共价键数目为0.4NA
B.常温常压下,7.8gNa2O2中含有阴离子的数目为0.1NA
C.1mol羟基与1mol氢氧根离子所含电子数均为9NA
D.在1.0L 0.1mol·L-1Na2CO3溶液中,阴离子总数小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下在石膏转化为硫酸钾和氯化钙的工艺流程示意图。

(1)本工艺中所用的原料除CaSO4·2H2O外,还需要____________等原料。
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:__________________。
(3)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32—的方法是:_______________。
(4)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是________。
a.熔点较低(29 ℃熔化) b.能导电 c.易溶于水 d.无毒
(5)上述工艺流程中体现绿色化学理念的是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列广告用语在科学上没有错误的是 ( )
A.这种饮料中不含任何化学物质
B.这种蒸馏水绝对纯净,其中不含任何离子
C.这种口服液含丰富的氮、磷、锌等微量元素
D.没有水就没有生命
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
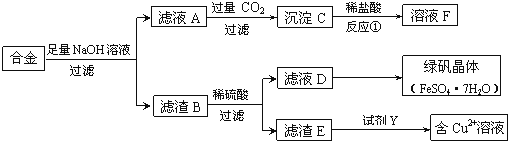
(1)合金与足量氢氧化钠溶液反应的离子方程式是 。
(2)若D中含有Fe3+,除去Fe3+的常用试剂是 。
(3)若要从滤液D中得到绿矾晶体,必须进行的实验操作步骤: 、冷却结晶、过滤、自然干燥。
(4)若由滤渣E得到含Cu2+的溶液,试剂Y可能是 (填选项字母)。
A.稀硝酸 | B.浓硫酸 | C.浓盐酸 | D.稀硫酸 |
根据所选试剂写出一个由滤渣E得到含Cu2+溶液的化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com