
【题目】对于反应3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2既做氧化剂又做还原剂
B. 被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C. Cl2是氧化剂,NaOH是还原剂
D. 氧化剂得电子数与还原剂失电子数之比为5∶1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述中,正确的是( )
A. 含20.0gNaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.8kJ·mol-1
B. 已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
C. 已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,则H2的燃烧热为241.8kJ·mol-1
D. 已知石墨转化为金刚石为吸热,那么石墨比金刚石稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用下列方法制取NH3:
①固体Ca(OH)2与NH4Cl共热。
②NH4HCO3固体中加NaOH固体(过量),常温下即能产生NH3;装置如图。
![]()
③NaOH固体中加入浓氨水。
④NH4Cl浓溶液中加生石灰。
请回答下列问题:
(1)写出②方法制取氨气的化学方程式___________________________。
(2)说明③方法制取氨气的原理:_____________,为什么此法不加热? __________。
(3)请从下面的仪器中选择④方法制取氨气的发生装置________(写字母,要求使用仪器最少、合理)。

写出用NH4Cl浓溶液与生石灰反应制取氨气的理由:__________。

(4)某同学设计了如图装置收集氨气,下列说法不正确的是________(填字母)。
A.收集氨气的原理是向下排空气法
B.干燥管的作用是防止倒吸
C.当烧杯中的水变红时证明氨气已收集满
D.该装置会形成红色喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NO、NO2、碳氢化合物等多种污染物。回答下列问题:
(1)已知:2C8H18(1)+25O2(g)=16CO2(g)+18H2O(g) △H1=-10244kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2
2NO(g)+2CO(g)=N2(g)+2CO2(g) △H3=-746kJ·mol-1
①若H2O(1)=H2O(g) △H=+44kJ·mol-1,则表示辛烷燃烧热的热化学方程式为______________________________________________。
②部分化学键键能数据如下:
化学键 | O=O | C=O | C≡O |
E/(kJ·mol) | 494 | 799 | 1076 |
△H2=__________kJ·mol-1
(2)1573K时,N2+O2![]() 2NO平衡常数为2. 0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0. 2mol、0. 001mol,则生成NO的物质的量为__________mol,N2的转化率为__________。
2NO平衡常数为2. 0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0. 2mol、0. 001mol,则生成NO的物质的量为__________mol,N2的转化率为__________。
(3)反应NO(g)+CO(g)=N2(g)+CO2(g)的平衡常数为1. 68×1060,从热力学角度看,该反应程度应该很大,实际汽车尾气中该反应的程度很小,原因是________________,要增大汽车尾气净化装置中单位时间内该反应的程度,关键是要_____________。
(4)T<500K时,反应NO2(g)+CO(g)=NO(g)+CO2(g)分两步进行:
第一步:NO2(g)+NO2(g)→NO3(g)+NO(g) (慢反应)
第二步:NO3(g)+CO(g)→NO(g)+CO2(g) (快反应)
下列表述正确的是__________(填标号)
A. 反应速率与NO浓度有关 B. 反应速率与NO2浓度有关
C. 反应的中间产物只有NO3 D. 第二步反应活化能较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的电解装置可实现低电位下高效催化还原CO2。下列说法不正确的是( )
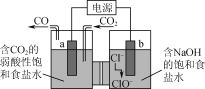
A.a极连接外接电源的负极
B.电解过程中Na+从右池移向左池
C.b极的电极反应式为Cl--2e-+H2O=ClO-+2H+
D.外电路上每转移1 mol电子,理论可催化还原标况下CO2气体11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据实验操作和现象所得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向盛有KI3溶液的试管中加入适量CCl4,振荡后静置,CCl4层显紫色(已知I3- | KI3在CCl4中的溶解度比在水中的大 |
B | 向淀粉溶液中加入稀硫酸水浴加热后,再加入银氨溶液水浴加热,未出现银镜 | 淀粉未发生水解 |
C | 向饱和Na2CO3溶液中加入少量BaSO4粉末搅拌,过滤,向洗净的沉淀中加入稀盐酸,有气体放出 | Ksp(BaSO4)>Ksp(BaCO3) |
D | 向新制饱和氯水中滴加紫色石蕊试液,溶液先变红后褪色 | 氯水具有酸性和漂白性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:单质A为目前人类使用最广泛的金属,氧化物B为具有磁性的黑色晶体,根据下列转化关系填空。
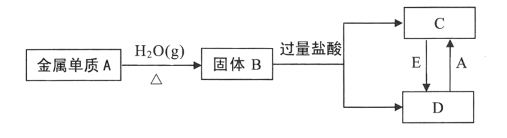
(1)试判断:A的化学式为___,B的名称为___。
(2)实验室检验C溶液中的阳离子时,可加入氢氧化钠溶液,若先产生___色沉淀,该沉淀在空气中迅速变为灰绿色,最终变为___色,则含该离子。沉淀转化的化学方程式为___。
(3)实验室检验D溶液中的阳离子时,通常可滴加___,若溶液变为___色,则含该离子。
(4)若E是一种黄绿色气体单质,该气体是___,在C→D过程中,此气体做___剂。
(5)写出D +A→C的离子方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。粗盐中含Ca2+、Mg2+、SO42-以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯:
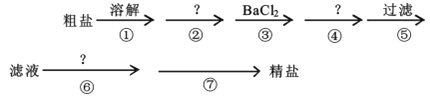
(1)④步所加试剂是___。
(2)第⑥步发生反应的离子方程式为___、___。
(3)第⑦步的操作名称___,需要的玻璃仪器有___、___。
(4)通过步骤⑤中过滤后的滤液,检验SO42-已除尽的操作方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组模拟工业上从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)中提取氧化铝的工艺做实验,流程如下:
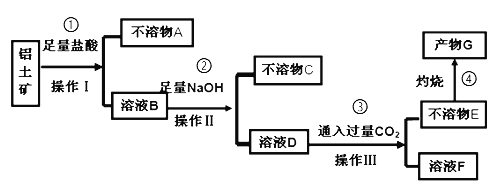
请回答下列问题:
(1)操作Ⅰ的名称为_________。
(2)验证溶液B中是否含有Fe3+的方法:_______________________________。
(3)不溶物A是_____(填化学式),写出③中D→E反应的离子方程式_____________________________。
(4)步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O、Fe3++3OH﹣=Fe(OH)3↓还有______________________________。
(5)如果铝土矿10g,步骤④中灼烧后得不溶物G质量为5.1g,则矿石中铝元素的含量为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com