
| 一元酸 | c(一元酸)/mol?L-1 | c(NaOH)/mol?L-1 | 混合液的pH | |
| 实验一 | HA | 0.1 | 0.1 | pH=a |
| 实验二 | HB | 0.12 | 0.1 | pH=7 |
| 实验三 | HC | 0.2 | pH>7 |


科目:高中化学 来源: 题型:
| A、Cu2+、Na+、OH- |
| B、H+、Cl-、CH3COO- |
| C、Fe3+、H+、NO3- |
| D、K+、Ca2+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | 原子结构或元素性质 |
| X | 最高正价=|最低负价| |
| Y | 原子核及核外各层电子的排布情况如图: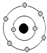 |
| Z | 原子结构示意图: |
| L | 原子半径为同周期主族元素中最大 |
| M | 其原子序数比L大2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HNO3 ② |
③NaOH ④ |
⑤Na2SO4 ⑥ |
⑦SO2 ⑧SO3 |
⑨NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 目的 | |
| A | 取绿豆大的钠分别加入到水和乙醇中 | 证明乙醇羟基中氢原子不如水分 子中氢原子活泼 |
| B | 取绿豆大的钠与钾分别投入水中 | 证明钾的金属性强于钠 |
| C | 将石蜡油在催化作用下,加强热产生的气 体通入溴的四氯化碳溶液中 |
证明产物不都是烷烃 |
| D | 蔗糖溶液加稀硫酸,水浴加热一段时间 后,加新制备的Cu(OH)2,加热 |
证明蔗糖水解后产生葡萄糖 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,测得醋酸钠溶液的pH>7 |
| B、常温下,中和等物质的量浓度等体积的醋酸和盐酸溶液,消耗氢氧化钠溶液体积相等 |
| C、常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4 |
| D、常温下,等量形状相同的锌粒分别与等pH的醋酸和盐酸反应,反应过程中醋酸速率较快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com