
【题目】请用化学用语回答下列问题:
(1)漂白粉的有效成分为 .
(2)标出氢化钠中氢元素的化合价: .
(3)NaHSO4在水中溶解时的电离方程式为 .
(4)工业合成氨的化学方程式为 .
(5)加热饱和FeCl3溶液形成Fe(OH)3胶体的离子方程式为 .
(6)向明矾水溶液中加入过量的氢氧化钡溶液,发生反应的离子方程式为 .
【答案】
(1)次氯酸钙
(2)![]()
(3)NaHSO4=Na++H++SO42﹣
(4)N2+3H2 ![]() 2NH3
2NH3
(5)Fe3++3H2O ![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
(6)Al3++2SO ![]() +2Ba2++4OH﹣=2BaSO4↓+ AlO
+2Ba2++4OH﹣=2BaSO4↓+ AlO ![]() +2H2O
+2H2O
【解析】解:(1)漂白粉是利用氢氧化钙和氯气反应生成,成分为氯化钙和次氯酸钙,有效成分为次氯酸钙,和二氧化碳、水反应生成次氯酸起到漂白作用,所以答案是:次氯酸钙;(2)氢化钠中钠元素化合价为+1价,依据元素化合价代数和为0计算氢元素的化合价为﹣1价,标注为: ![]() ,所以答案是:
,所以答案是: ![]() ;(3)NaHSO4在水中溶解时完全电离,电离方程式为NaHSO4=Na++H++SO
;(3)NaHSO4在水中溶解时完全电离,电离方程式为NaHSO4=Na++H++SO ![]() ,所以答案是:NaHSO4=Na++H++SO
,所以答案是:NaHSO4=Na++H++SO ![]() ;(4)合成氨发生反应的化学方程式为N2+3H2
;(4)合成氨发生反应的化学方程式为N2+3H2 ![]() 2NH3 , 所以答案是:N2+3H2
2NH3 , 所以答案是:N2+3H2 ![]() 2NH3;(5)饱和FeCl3溶液为原料制备Fe(OH)3胶体的离子方程式为:Fe3++3H2O
2NH3;(5)饱和FeCl3溶液为原料制备Fe(OH)3胶体的离子方程式为:Fe3++3H2O ![]() Fe(OH)3↓+3H+ , 所以答案是:Fe3++3H2O
Fe(OH)3↓+3H+ , 所以答案是:Fe3++3H2O ![]() Fe(OH)3↓+3H+;(6)向明矾溶液中加入过量的氢氧化钡溶液反应的离子方程式为Al3++2SO
Fe(OH)3↓+3H+;(6)向明矾溶液中加入过量的氢氧化钡溶液反应的离子方程式为Al3++2SO ![]() +2Ba2++4OH﹣=2BaSO4↓+AlO
+2Ba2++4OH﹣=2BaSO4↓+AlO ![]() +2H2O,所以答案是:Al3++2SO
+2H2O,所以答案是:Al3++2SO ![]() +2Ba2++4OH﹣=2BaSO4↓+ AlO
+2Ba2++4OH﹣=2BaSO4↓+ AlO ![]() +2H2O.
+2H2O.


科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A. 催化剂V2O5不改变该反应的逆反应速率
B. 增大反应体系的压强,反应速率一定增大
C. 该反应是放热反应,降低温度将缩短反应达到平衡的时间
D. 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在周期表中1~36号之间的W、X、Y、Z、Q六种元素,它们的原子序数依次增大,已知W与其余五种元素既不同周期也不同主族,X原子的L层p轨道中有2个电子,Y元素原子的最外层有3个自旋方向相同的未成对电子,Z元素原子基态时,核外电子排布在3个能级上,且有2个未成对电子.Q元素在第四周期,原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.
(1)按电子排布,Q元素在周期表中属区.
(2)第一电离能YZ,电负性YZ(填“>”,“=”或“<”).
(3)W与Z形成的常见化合物有W2Z、W2Z2 , W与Y能形成多种二元化合物,如YW3、Y2W4、Y3W5、Y4W6…,W2Z分子中Z原子的杂化类型为 , YW3分子的立体构型为 , YW3极易溶于W2Z的主要原因有 .
(4)若向含有Q2+的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有深蓝色晶体析出,该晶体阳离子中含有的化学键有 .
(5)Q+与Y3﹣形成的晶胞结构如图所示,阴、阳离子间的核间距为 a pm,阿伏伽德罗常数用NA 表示,则晶体的密度为gcm﹣3 . 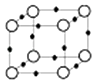
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在5L的密闭容器中充入2molA气体和1molB气体,在一定条件下发生反应:2A(g)+B(g) ![]() 2C(g),经4 s后达到平衡状态,在相同温度下测得容器内混合气体的物质的量是反应前的5/6.
2C(g),经4 s后达到平衡状态,在相同温度下测得容器内混合气体的物质的量是反应前的5/6.
(1)达到平衡时,C的物质的量浓度_________________
(2)达到平衡时,A的转化率___________________。
(3)达到平衡时,用物质B表示的化学反应速率为__________________。
(4)已知反应2CH3OH(g) ![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,某时刻在容积固定的容器中测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,某时刻在容积固定的容器中测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.43 | 0.4 | 0.4 |
比较此时正、逆反应速率的大小:v(正)____v(逆)(填“>”、“<”或“=”),若上述反应达到平衡时c(CH3OH)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作不能增大化学反应速率的是
A.把食物储存在冰箱里
B.双氧水分解时加入二氧化锰
C.实验室制备氢气用粗锌代替纯锌
D.用2mol/L 50mL的硫酸代替2mol/L 50mL的盐酸与大小、形状、纯度相同的锌粒反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.强电解质溶液的导电能力一定比弱电解质溶液强
B.中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠等于醋酸
C.将氢氧化钠和氨水溶液各稀释一倍,两者的OH﹣浓度均减少到原来的 ![]()
D.如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度也是醋酸的二倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应( )
A.H2SO4+2NaOH═Na2SO4+2H2O
B.NH3+HCl═NH4Cl
C.2NaHCO3 ![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
D.CuO+H2 ![]() Cu+H2O
Cu+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com